题目内容
15.实验室有两瓶常温下的饱和溶液,已知它们是氢氧化钠溶液和石灰水,为了区分并验证它们的性质,张林和李莉同学进行了如下探究实验.(一)张林同学用物理方法鉴别它们.他从两瓶溶液中各取出来少许分别装入试管并在酒精灯火焰上加热.他根据甲中溶液变浑浊现象,判断甲瓶为石灰水.
(二)李莉同学用化学方法鉴别它们.她从两瓶溶液取出来少许装入试管并向里面吹气,也判断出甲瓶为石灰水,她看到现象的化学反应方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
(三)乙瓶溶液敞放在空气中可能变质.为了探究乙瓶是否变质?以及变质后溶液中溶质的成分?两位同学做了如下猜测和实验.
【提出猜想】:①只有NaOH ②只有Na2CO3 ③Na2CO3和NaOH ④…
【查阅资料】:已知NaCl、CaCl2溶液呈中性,Na2CO3溶液能使酚酞变红.
【实验与结论】:
(1)取少许溶液并加入氢氧化钙溶液,看不到任何现象就可证明猜想①成立.
(2)若氢氧化钠溶液已经变质,要探究氢氧化钠溶液是否完全变质,他们做了如下实验.
| 实验步骤 | 实验现象 | 实验结论或方程式 |
| 步骤1:取少量已变质的NaOH溶液于试管中,加入过量的氯化钙溶液 | 产生白色沉淀 | 反应方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl. |
| 步骤2:取步骤1所得的澄清溶液少许,并向清液滴入几滴酚酞. | 红色 | 猜想③成立 |
分析 根据氢氧化钙的溶解度随温度的升高而减小、碳酸钠和氢氧化钠的检验方法进行分析解答即可.
解答 解:(一) 氢氧化钙的溶解度随温度的升高而减小,故加热后溶液变浑浊的是石灰水,故填:甲中溶液变浑浊;
(二)二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,故填:CO2+Ca(OH)2═CaCO3↓+H2O;
实验与结论:猜想3成立则含有碳酸钠和氢氧化钠,要检验氢氧化钠的存在,首先检验并除去碳酸钠,可以加入氯化钙溶液,然后加入酚酞试液,酚酞试液变红则含有氢氧化钠,故填:氯化钙;Na2CO3+CaCl2═CaCO3↓+2NaCl;红色;
反思与交流:步骤1中所加溶液需过量,是为了除去碳酸钠,防止对氢氧化钠的检验造成干扰,故填:将碳酸钠完全除去转化为沉淀.
点评 熟练掌握氢氧化钠、碳酸钠的化学性质,知道氢氧化钠的变质的原因并能够选择合适的方法进行检验.记住反应的化学方程式.

练习册系列答案
相关题目
3.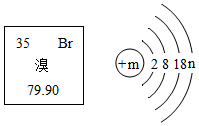 溴元素在元素周期表中的信息与溴原子结构示意图如图所示,下列说法正确的是( )
溴元素在元素周期表中的信息与溴原子结构示意图如图所示,下列说法正确的是( )
 溴元素在元素周期表中的信息与溴原子结构示意图如图所示,下列说法正确的是( )
溴元素在元素周期表中的信息与溴原子结构示意图如图所示,下列说法正确的是( )| A. | 溴相对原子质量为79.90g | |
| B. | 溴原子质量由构成其原子的质子和电子决定 | |
| C. | 溴元素属于金属元素 | |
| D. | m=35、n=7 |
20.我国科学家已研制出新型高效光催化剂作用下,利用太阳能分解水制取氢气.水在通过并接触催化剂表面时,分解的微观过程用示意图表示如下:(“○”表示氢原子,“●”表示氧原子,“ ”表示催化剂).则水分解微观过程的正确顺序是 ( )
”表示催化剂).则水分解微观过程的正确顺序是 ( )

 ”表示催化剂).则水分解微观过程的正确顺序是 ( )
”表示催化剂).则水分解微观过程的正确顺序是 ( )
| A. | ①②③④⑤ | B. | ③⑤②④① | C. | ①④②⑤③ | D. | ①④⑤②③ |
7.空气中含量较多,且能用于填充食品包装袋的气体是( )
| A. | 氮气 | B. | 氧气 | C. | 稀有气体 | D. | 氢气 |
4.对某无色溶液所含溶质的分析,合理的是( )
| A. | NaOH、Na2CO3、NaCl | B. | KNO3、NaCl、FeCl2 | ||
| C. | HCl、NaOH、NaCl | D. | Na2CO3、Ca(OH)2、NaCl |
5.大海里蕴藏着丰富的资源,海南某海洋研究所以含有CaCl2、MgCl2的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图:

下列有关说法错误的是( )

下列有关说法错误的是( )
| A. | 流程中操作Ⅰ名称是过滤 | B. | 操作Ⅱ酸化选择稀硫酸 | ||
| C. | 反应①属于分解反应 | D. | “滤液”中可能含有两种溶质 |
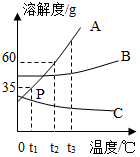 A、B、C三种物质的溶解度曲线如图所示,请回答:
A、B、C三种物质的溶解度曲线如图所示,请回答:
 在实验课上,同学们用锌和稀硫酸反应制取氢气,小明取反应后的溶液164.7g,滴入碳酸钠溶液,先后有气体和白色沉淀生成,加入碳酸钠溶液与生成沉淀或气体的质量关系如图.
在实验课上,同学们用锌和稀硫酸反应制取氢气,小明取反应后的溶液164.7g,滴入碳酸钠溶液,先后有气体和白色沉淀生成,加入碳酸钠溶液与生成沉淀或气体的质量关系如图.