题目内容
12.海洋中蕴藏着丰富的化学资源,人类应合理开发利用,试回答下列相关问题:(1)海水淡化:
下列方法中不能从海水中获取淡水资源的是A.
A.过滤 B.蒸馏 C.结晶脱水 D.蒸发结晶
(2)海水晒盐:
从海水中提取食盐的基本方法是蒸发结晶(填“蒸发结晶”或“降温结晶”).
(3)海水制镁:
金属镁广泛应用于火箭、导弹和飞机制造业等,可通过如图1流程从海水中提取制备:
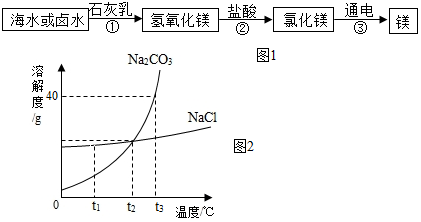
①如图1中生成沉淀的反应化学方程式为MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,该反应属于复分解反应(填“化合”、“分解”、“复分解”、“氧化”之一).
②海水制镁中须经历“MgCl2→Mg(OH)2→MgCl2”的转化过程,这样做的目的是富集氯化镁,得到纯净的氯化镁.
(4)海水制“碱”:
1926年,我国著名化学家侯德榜先生创立了“联合制减法”(即侯氏制碱法),以食盐为主要原料制取纯碱.与比利时化学家索尔维发明的“氨碱法”相比,将原料利用率提高到96%且副产物无污染可作氮肥,开创了世界制碱工业的新纪元.
(5)如图2为氯化钠和碳酸钠的溶解度曲线:
①下列说法正确的是B.
A.t1℃时,Na2CO3溶解度大于NaCl溶解度
B.t2℃时,饱和Na2CO3溶液与饱和NaCl溶液溶质质量分数相等
C.t3℃时,100g水中最多溶解50gNa2CO3
D.NaCl的溶解度受温度变化的影响比Na2CO3的大
②t3℃时,将25gNa2CO3固体放入50g水中,充分溶解后,可得到Na2CO3的饱和溶液(填“饱和”或“不饱和”),所得溶液的质量为70g.
③下列方法中能将饱和Na2CO3溶液变为不饱和溶液的是BE(填序号).
A.加Na2CO3固体 B.加水 C.恒温蒸发水 D.降温 E.升温
④将t2℃时等质量的饱和NaCl和Na2CO3溶液降温至t1℃,所得溶液的质量关系:NaCl溶液质量>Na2CO3溶液质量(填“>”、“=”或“<”).
⑤生活在盐碱湖附近的人们“夏晒盐,冬捞碱”,请结合溶解度曲线,说明谚语中“冬捞碱”的原理:碳酸钠的溶解度受温度的影响比较大,因此通过降温结晶得到碳酸钠.
分析 (1)根据过滤只能将不溶性杂质从溶液中分离进行分析;
(2)根据氯化钠的溶液溶解度受温度影响变化不大进行分析;
(3)①根据氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙进行分析;
②根据从海水屮提取MgCl2时.经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程是将海水中的镁离子提取出来,富集镁离子进行分析;
(4)根据我国著名化学家侯德榜先生创立了“联合制减法”(即侯氏制碱法),以食盐为主要原料制取碳酸钠进行分析;
(5)根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)过滤只能将不溶性杂质从溶液中分离,不能从海水中得到淡水,蒸馏、结晶脱水、蒸发结晶可以从海水中得到淡水,故选:A;
(2)氯化钠的溶液溶解度受温度影响变化不大,所以从海水中提取食盐的基本方法是蒸发结晶;
(3)①氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,化学方程式为:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,该反应属于复分解反应;
②海水中含有氯化镁,氯化镁溶解在海水中,不能直接提取出来,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程富集MgCl2,得到纯净的氯化镁,然后电解才能得到镁;
(4)我国著名化学家侯德榜先生创立了“联合制减法”(即侯氏制碱法),以食盐为主要原料制取碳酸钠;
(5)①A、通过分析溶解度曲线可知,t1℃时,Na2CO3溶解度小于NaCl溶解度,故A错误;
B、t2℃时,碳酸钠和氯化钠的溶解度相等,所以饱和Na2CO3溶液与饱和NaCl溶液溶质质量分数相等,故B正确;
C.t3℃时,碳酸钠的溶解度是40g,所以100g水中最多溶解40gNa2CO3,故C错误;
D.氯化钠的溶解度曲线较碳酸钠的溶解度曲线平缓,所以NaCl的溶解度受温度变化的影响比Na2CO3的小,故D错误.
故选:B;
②t3℃时,碳酸钠的溶解度是40g,所以将25gNa2CO3固体放入50g水中,充分溶解后,可得到Na2CO3的饱和溶液,所得溶液的质量为70g;
③碳酸钠的溶解度随温度的升高而增大,所以能将饱和Na2CO3溶液变为不饱和溶液的是加水,升温,故选:BE;
④将t2℃时等质量的饱和NaCl和Na2CO3溶液降温至t1℃,碳酸钠析出的晶体较多,所以所得溶液的质量关系:NaCl溶液质量>Na2CO3溶液质量;
⑤生活在盐碱湖附近的人们“夏晒盐,冬捞碱”,说明谚语中“冬捞碱”的原理:碳酸钠的溶解度受温度的影响比较大,因此通过降温结晶得到碳酸钠.
故答案为:(1)A;
(2)蒸发结晶;
(3)①MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,复分解;
②富集氯化镁,得到纯净的氯化镁;
(4)侯德榜,碳酸钠;
(5)①B;
②饱和,70;
③BE;
④>;
⑤碳酸钠的溶解度受温度的影响比较大,因此通过降温结晶得到碳酸钠.
点评 本题考查的知识较多,难度较大,需要逐题分析,然后结合学过的知识进行解答.

| A. | 用铝作导热材料 | B. | 用铜抽成丝做电线 | ||
| C. | 用氮气作食品防腐剂 | D. | 稀有气体充入霓虹灯 |
(1)初中化学有许多实验,为了便于研究我们可以把化学实验从“实验装置、物质的性质、探究的方法”等角度进行分类,据此应将下列实验中的D与C(填“A”或“B”或“C”)归为一类,依据是都是探究物质的性质.
 | 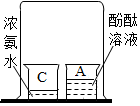 | 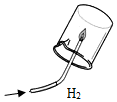 | 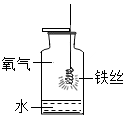 |
| A | B | C | D |
①Ca(ClO)2+2HCl═CaCl2+2HClO ②Cl2+H2O═HCl+HClO.

| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
| A. | 把银锭拉成银丝 | B. | 铁矿石炼铁 | ||
| C. | 从石油中分离出汽油 | D. | 蒸馏法淡化海水 |
| A. |  稀释浓硫酸 | B. |  蒸发溶液 | C. |  称量固体质量 称量固体质量 | D. |  测溶液的pH |