题目内容
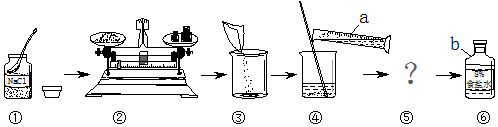
4.如图是配制50克5%的蔗糖溶液的操作
(1)需要蔗糖质量2.5g,需要水的体积47.5mL.
(2)配制溶液的正确顺序是①④②⑤③该实验中玻璃棒的作用是加速溶解
(3)如果实验时量筒仰视读数,则所得溶液小于5%.
分析 根据溶液的配制过程:计算、称量、溶解,解答题目,注意过程中仪器的选择和使用,以及进行误差分析.
解答 解:(1)50g5%的蔗糖溶液需要的蔗糖的质量为50g×5%=2.5g.需要的水的质量为50g-2.5g=47.5g,折合体积为47.5mL.
(2)配制溶液的过程中先取药品,称量药品,将药品放入烧杯中,加入量取的水,搅拌(加固体后液体,这样能加固体的溶解).玻璃棒在溶解过程的作用是加速溶解;
(3)仰视读数,会导致读数偏小,实际体积偏大,也就是加入的水多于应该的数值,所以所得溶液的质量分数会小于5%.
故答案为:(1)2.5g; 47.5mL;(2)①④②⑤③;加快溶解;(3)小于.
点评 误差分析中要结合质量分数的公式进行,注意各种误差因素的分析.

练习册系列答案
相关题目
14.决定元素化学性质的原因是( )
| A. | 最外层电子数不同 | B. | 中子数不同 | ||
| C. | 相对原子质量不同 | D. | 中子数与核外电子数之和不同 |
16.下列化学式书写错误的是( )
| A. | 生石灰 CaO | B. | 纯碱 NaCO3 | C. | 烧碱 NaOH | D. | 熟石灰 Ca(OH)2 |
14.往Ag NO3溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出.下列分析正确的是( )
| A. | 滤液中一定有Ag NO3、Fe(NO3)2 | |
| B. | 滤渣中一定有铁和银 | |
| C. | 滤渣中一定有银,可能有铁 | |
| D. | 滤液中一定有Fe(NO3)2,可能有Ag NO3 |
 小陈把一根用砂纸打磨过的铁丝弯成螺旋状,放入试管中,如图所示.
小陈把一根用砂纸打磨过的铁丝弯成螺旋状,放入试管中,如图所示.