��Ŀ����
17���ҹ���ѧ�Һ��ġ������Ƽ�����ռ��Ч�ʸߣ�����Ҫ��Ӧ���£���NH3+H2O+CO2�TNH4HCO3
��NaCl�����ͣ�+NH4HCO3�TNH4C1+NaHCO3��
��2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2��
����˵����ȷ���ǣ�������
| A�� | �ڷ�Ӧ�Ǹ��ֽⷴӦ | |
| B�� | �۷�Ӧ������̼Ԫ�صĻ��ϼ۷����˸ı� | |
| C�� | �۷�Ӧ���H2O��CO2���Ա�ѭ��ʹ�� | |
| D�� | ��Ӧ������ֻ�õ�һ�ֲ���Na2CO3 |
���� ���ֻ�����������ɷ����������µĻ�����ķ����Ǹ��ֽⷴӦ��
��������Ԫ�ػ��ϼ۴�����Ϊ�㣻
���ݹ������̿����жϿ���ѭ�����õ����ʼ����������࣮
��� �⣺A�������Ȼ��ƺ�̼����立�Ӧ�������Ȼ�狀�̼�����ƣ����ڸ��ֽⷴӦ����ѡ��˵����ȷ��
B��NaCl�����ͣ�+NH4HCO3�TNH4C1+NaHCO3���У���Ӧǰ��Ԫ�صĻ��ϼ۶�û�з����ı䣬��ѡ��˵������ȷ��
C���۷�Ӧ���H2O��CO2���Ա�ѭ��ʹ�ã�������Ϊ���еķ�Ӧ���к���ˮ�Ͷ�����̼����ѡ��˵����ȷ��
D����Ӧ�����������̼���ơ�ˮ�Ͷ�����̼�����ʣ���ѡ��˵������ȷ��
��ѡ��AC��
���� ������Ҫ�������ʵ����ʣ����ʱҪ���ݸ������ʵ����ʣ���ϸ������������з������жϣ��Ӷ��ó���ȷ�Ľ��ۣ�

��ϰ��ϵ�д�
�����Ŀ
1�������й�����ͭ�������У����ڻ�ѧ���ʵ��ǣ�������
�٣�����ͭ����������ˮ�����ڣ�����ͭ�������ɫ�����ۣ�����ͭ��������ʱ�����ɫ��Ϊ��ɫ���ܣ�������ͭ��Һ�еμ�����������Һ�������ɫ������
�٣�����ͭ����������ˮ�����ڣ�����ͭ�������ɫ�����ۣ�����ͭ��������ʱ�����ɫ��Ϊ��ɫ���ܣ�������ͭ��Һ�еμ�����������Һ�������ɫ������
| A�� | �٢� | B�� | �ڢ� | C�� | �ۢ� | D�� | �٢� |
9��þ����Ϊ����������������ҵ��ͨ���ú�ˮ��ȡ����þ������������������
����һ��
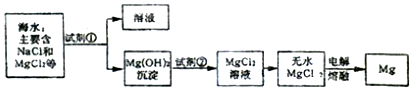
��������
��ش��������⣺
��1��ÿ���Լ��۸����
��ҵ����Ϊ�˻�ø��ߵ��������ϱ����������ѡ�������һ����������
��2��������м����Լ���ַ�Ӧ��IJ����ǹ��ˣ�
��3������۷�����Ӧ�Ļ�ѧ����ʽMg��OH��2+2HCl=MgCl2+2H2O��
��4����MgCl2$\frac{\underline{\;ͨ��\;}}{\;}$Mg+Cl2����Ӧ�л��ϼ۷����仯��Ԫ����2�֣�
����һ��

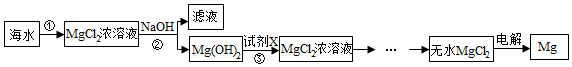
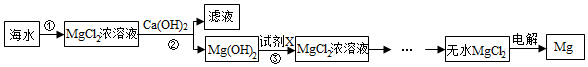
��������

��ش��������⣺
��1��ÿ���Լ��۸����
| �Լ� | NaOH | Ca��OH��2 |
| �۸�Ԫ/t�� | 3200 | 1200 |
��2��������м����Լ���ַ�Ӧ��IJ����ǹ��ˣ�
��3������۷�����Ӧ�Ļ�ѧ����ʽMg��OH��2+2HCl=MgCl2+2H2O��
��4����MgCl2$\frac{\underline{\;ͨ��\;}}{\;}$Mg+Cl2����Ӧ�л��ϼ۷����仯��Ԫ����2�֣�
6����һ����ɫ��ĩ���������Ȼ��ơ������ơ�����ͭ��̼���ơ�̼����е�һ�ֻ�����ɣ�Ϊȷ������ɣ���������ʵ�飮
�ٳ�ȡһ�������ĸð�ɫ��ĩ����ˮ���ܽ⣬����ɫ��ҺA��
������ɫ��ҺA�м�������Ȼ�����Һ����ַ�Ӧ����ˣ��ֱ����ɫ��ҺB�Ͱ�ɫ����C������ɫ����Cϴ�ӡ���ɺ�Ƶ�����Ϊ10g��
����10g��ɫ����C�м���������ϡ���ᣬ����������ʧ����������ð����
������ɫ��ҺB�еμ���������Һ��ϡ���ᣬ������ɫ����
������ʵ��ó��������ж��У���ȷ���ǣ�������
�ٳ�ȡһ�������ĸð�ɫ��ĩ����ˮ���ܽ⣬����ɫ��ҺA��
������ɫ��ҺA�м�������Ȼ�����Һ����ַ�Ӧ����ˣ��ֱ����ɫ��ҺB�Ͱ�ɫ����C������ɫ����Cϴ�ӡ���ɺ�Ƶ�����Ϊ10g��
����10g��ɫ����C�м���������ϡ���ᣬ����������ʧ����������ð����
������ɫ��ҺB�еμ���������Һ��ϡ���ᣬ������ɫ����
������ʵ��ó��������ж��У���ȷ���ǣ�������
| A�� | ��ɫ��ĩ�п��ܺ����Ȼ��� | |
| B�� | ��ɫ��ҺB�п��ܺ����������� | |
| C�� | ��ɫ��ĩ�в���̼��ơ������ơ�����ͭ | |
| D�� | ��������ɵ���������������2.2g |
7��ijͬѧ��������������ȼ�յ�ʵ�鷽������ͼ��ʾ�����в��������ǣ�������
| A�� |  ľ̿��������ȼ�� | B�� |  ��˿��������ȼ�� | ||
| C�� |  ����������ȼ�� | D�� |  ������������ȼ�� |



 ʵ������һ������������غͶ���������ȡ�������ش��������⣮
ʵ������һ������������غͶ���������ȡ�������ش��������⣮