题目内容
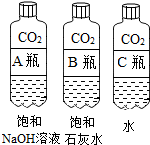
7.实验设计是化学实验的重要环节,请根据下列实验要求问答相关问题:【探究一】用对比实验方法探究二氧化碳的性质
| 实验一 | 实验二 |
 | 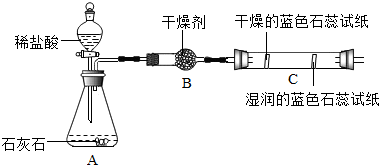 |
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色.
【探究二】用控制变量方法探究影响物质溶解性的因素.
| 实验三 | 实验四 |
 |  |
【探究三】探究不同酸具有相似的化学性质,但性质也存在差异

(4)图中能体现酸的通的是ABD(填字母序号);稀盐酸不能与氯化钡溶液反应,而稀硫酸则能与之反应,本质的原因是它们在水溶液中电离出来的阴离子或酸根离子不同,据图从微观的角度分析稀硫酸和氯化钡溶液反应的实质是Ba2++SO42-=BaSO4↓.
分析 (1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生的反应是:二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,对比A瓶与C瓶的实验现象,可证明CO2能与NaOH发生反应;(2)根据二氧化碳溶于水生成碳酸进行分析;
(3)根据硝酸钾、氯化钠的溶解性进行回答;
(4)酸类因为溶于水时电离出的阳离子相同,有相同的化学性质,又因为溶于水时电离出的阴离子或酸根离子不同,其性质也存在差异;
解答 解:(1)用对比实验方法探究二氧化碳的性质:实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生的反应是:二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,对比A瓶与C瓶的实验现象,可证明CO2能与NaOH发生反应;故答案为:Ca(OH)2+CO2=CaCO3↓+H2O;C;
(2)实验二观察到C装置中发生的现象是:干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色;因为二氧化碳溶于水生成碳酸;故答案为:干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色;
(3)硝酸钾在低温不溶,加热继续溶解,说明物质的溶解性与温度有关;氯化钠不溶于酒精,而溶于水.故实验呈现的不同现象能说明物质的溶解性与溶剂种类有关;故填:温度;溶剂种类;
(4)酸类因为溶于水时电离出的阳离子相同,有形同的化学性质,又因为溶于水时电离出的阴离子或酸根离子不同,其性质也存在差异;氯化钡溶液与硫酸溶液反应的条件是钡离子和硫酸根离子产生硫酸钡沉淀,故该反应的实质是:Ba2++SO42-=BaSO4↓;故填:ABD;阴离子或酸根离子;Ba2++SO42-=BaSO4↓;
点评 本题考查知识面较广,注意通过给出微粒的模型,考查学生的知识迁移能力和对复分解反应的应用能力.

 阅读快车系列答案
阅读快车系列答案(1)学校实验室有一批生锈报废的铁架台,它们生锈的原因是铁与空气中的水蒸气和氧气接触发生了化学反应.
(2)城市中人行天桥的建成,极大地方便了市民安全出行,建桥使用的不锈钢属于金属材料.
(3)大量煤燃烧产生的SO2,机动车尾气排放出来的氮氧化物,它们与水反应降落在地面上形成酸雨.
(4)科学膳食是人类健康的保障,下表是某学校食堂的食谱,从所含营养素角度分析
| 主食 | 米饭 馒头 |
| 副食 | 红烧肉 鸡蛋 豆腐汤 |
| 饮料 | 纯净水 可乐 |
A.牛肉 B.清蒸鱼 C.青菜 D.牛奶.
 烧杯中盛有CaCl2和HCl的混合溶液,向其中滴加Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法错误的是( )
烧杯中盛有CaCl2和HCl的混合溶液,向其中滴加Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法错误的是( )| A. | a点的溶质为HCl、NaCl | |
| B. | ab段反应产生大量气泡 | |
| C. | bc段反应的方程式为CaCl2+Na2CO3═2NaCl+CaCO3↓ | |
| D. | 取d点溶液滴加酚酞试液,溶液显红色 |
| A. | 合金-不锈钢、锌 | B. | 碳单质-金刚石、石墨、C60 | ||
| C. | 化石燃料-煤、氢气、天然气 | D. | 天然材料-涤纶、棉花 |

 通过化学启蒙学习,同学们对组成万物的基本物质有了进一步了解.
通过化学启蒙学习,同学们对组成万物的基本物质有了进一步了解.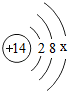 ,其中x=4.
,其中x=4.

 为测定某黄铜中铜的质量分数,小欣进行以下实验:取10.0g黄铜样品与足量稀盐酸充分反应,产生的氢气与反应时间的函数关系如图
为测定某黄铜中铜的质量分数,小欣进行以下实验:取10.0g黄铜样品与足量稀盐酸充分反应,产生的氢气与反应时间的函数关系如图