题目内容
17. 为测定某黄铜中铜的质量分数,小欣进行以下实验:取10.0g黄铜样品与足量稀盐酸充分反应,产生的氢气与反应时间的函数关系如图
为测定某黄铜中铜的质量分数,小欣进行以下实验:取10.0g黄铜样品与足量稀盐酸充分反应,产生的氢气与反应时间的函数关系如图(1)产生氢气的质量是0.1g
(2)计算样品中铜的质量分数
(3)t1-t2时间段产生气泡速度放缓的原因是稀盐酸的溶质质量分数在反应中逐渐降低.
分析 (1)根据图象中的数据分析生成氢气的质量;
(2)根据生成氢气的质量,依据化学方程式进行计算;
(3)根据盐酸的浓度会影响反应速率.
解答 解:(1)产生氢气的质量是0.1g;
(2)设样品中锌的质量为x
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.1g
$\frac{65}{x}$=$\frac{2}{0.1g}$
x=3.25g
所以样品中铜元素的质量分数为:$\frac{10g-3.25g}{10g}$×100%=67.5%;
(3)通过分析可知,t1-t2时间段产生气泡速度放缓的原因是:稀盐酸的溶质质量分数在反应中逐渐降低.
故答案为:(1)0.1g;
(2)样品中铜元素的质量分数为67.5%;
(3)稀盐酸的溶质质量分数在反应中逐渐降低.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

练习册系列答案
相关题目
7.实验设计是化学实验的重要环节,请根据下列实验要求问答相关问题:
【探究一】用对比实验方法探究二氧化碳的性质
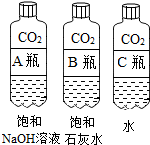
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色.
【探究二】用控制变量方法探究影响物质溶解性的因素.
(3)实验三目的是探究温度对物质溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响.
【探究三】探究不同酸具有相似的化学性质,但性质也存在差异

(4)图中能体现酸的通的是ABD(填字母序号);稀盐酸不能与氯化钡溶液反应,而稀硫酸则能与之反应,本质的原因是它们在水溶液中电离出来的阴离子或酸根离子不同,据图从微观的角度分析稀硫酸和氯化钡溶液反应的实质是Ba2++SO42-=BaSO4↓.
【探究一】用对比实验方法探究二氧化碳的性质
| 实验一 | 实验二 |
 | 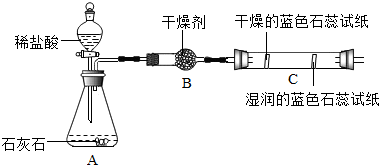 |
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色.
【探究二】用控制变量方法探究影响物质溶解性的因素.
| 实验三 | 实验四 |
 |  |
【探究三】探究不同酸具有相似的化学性质,但性质也存在差异

(4)图中能体现酸的通的是ABD(填字母序号);稀盐酸不能与氯化钡溶液反应,而稀硫酸则能与之反应,本质的原因是它们在水溶液中电离出来的阴离子或酸根离子不同,据图从微观的角度分析稀硫酸和氯化钡溶液反应的实质是Ba2++SO42-=BaSO4↓.
12.下列成语中蕴含化学变化的是( )
| A. | 百炼成钢 | B. | 花香四溢 | C. | 滴水成冰 | D. | 扬汤止沸 |
6. 如图是a、b两种物质的溶解度曲线,下列分析正确的是( )
如图是a、b两种物质的溶解度曲线,下列分析正确的是( )
 如图是a、b两种物质的溶解度曲线,下列分析正确的是( )
如图是a、b两种物质的溶解度曲线,下列分析正确的是( )| A. | 溶解度:a>b | |
| B. | 可采用降温方法将a的接近饱和的溶液变为饱和溶液 | |
| C. | 将t2℃时100ga的饱和溶液降温至t1℃,析出30ga | |
| D. | 将t2℃时a、b的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是a>b |



 如图中A、B、C是三种粒子的结构示意图.请回答下列问题:
如图中A、B、C是三种粒子的结构示意图.请回答下列问题: