题目内容
 如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂.为了确定盐酸与氢氧化钠是否恰好完全反应,成员甲从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.他们依据所学的知识,对此展开探究:
如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂.为了确定盐酸与氢氧化钠是否恰好完全反应,成员甲从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.他们依据所学的知识,对此展开探究:(1)猜想与假设:下面是组内三位同学所做的猜想,请你完成丙同学的猜想.
【猜想一】甲同学:“两种物质已恰好完全中和”;
【猜想二】乙同学:“两种物质反应后氢氧化钠过量”;
【猜想三】丙同学:
(2)实验与结论:
①中和反应方程式:
②乙同学刚提出自己的猜想,就遭到另外两位同学的否定,两位同学的理由是:
③为了验证自己的猜想,甲同学设计了以下验证方案:
| 实验步骤 | 实验现象 | 实验结论 |
| 用洁净、干燥的玻璃棒从烧杯中蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比. | pH (填“>”、“=”或“<”) | 猜想一不成立 |
| 实验步骤 | 实验现象 | 实验结论 |
| 猜想三: (填“成立”或“不成立”) |
| 实验步骤 | 实验现象 | 实验结论 |
考点:中和反应及其应用,溶液的酸碱度测定,酸的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的酸 酸的通性
分析:【猜想三】据反应过程中的反应物可能有剩余分析;
(2)实验与结论:
①据质量守恒定律书写化学方程式;
②据碱使无色酚酞变红分析;
③据酸的PH小于7分析;
④据酸能够使紫色石蕊试液变红分析;
(3)据酸的性质设计实验即可;
(2)实验与结论:
①据质量守恒定律书写化学方程式;
②据碱使无色酚酞变红分析;
③据酸的PH小于7分析;
④据酸能够使紫色石蕊试液变红分析;
(3)据酸的性质设计实验即可;
解答:【猜想三】丙同学的猜想是:两种物质反应后稀盐酸过量,溶液显酸性.
(2)实验与结论:
①由题目可知,反应物是氢氧化钠和盐酸,故中和反应方程式:NaOH+HCl=NaCl+H2O
②向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色,说明氢氧化钠不会有剩余;
③由以上分析知,氢氧化钠不会有剩余,由图知猜想一不成立,也就是不是恰好反应,故酸有剩余,PH应小于7;
④
(3)实验步骤:从烧杯中取出少量反应后的溶液于另一支试管中,加入亮丽锌粒,观察现象;
实验现象:有气泡冒出;
实验结论:猜想三成立
故答案为:(1)猜想三:两种物质反应后稀盐酸过量,溶液显酸性.
(2)①NaOH+HCl=NaCl+H2O
②理由是:若氢氧化钠有剩余,则反应后滴入无色酚酞溶液就不会出现无色的现象,而溶液会变红才对.
③<
④实验步骤:从烧杯中取出少量反应后的溶液于另一支试管中,用胶头滴管滴加1-2滴紫色石蕊溶液,振荡,观察现象;
实验现象:溶液变红
实验结论:猜想三成立
(3)实验步骤:从烧杯中取出少量反应后的溶液于另一支试管中,加入亮丽锌粒,观察现象;
实验现象:有气泡冒出;
实验结论:猜想三成立
(2)实验与结论:
①由题目可知,反应物是氢氧化钠和盐酸,故中和反应方程式:NaOH+HCl=NaCl+H2O
②向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色,说明氢氧化钠不会有剩余;
③由以上分析知,氢氧化钠不会有剩余,由图知猜想一不成立,也就是不是恰好反应,故酸有剩余,PH应小于7;
④
| 实验步骤 | 实验现象 | 实验结论 |
| 从烧杯中取出少量反应后的溶液于另一支试管中,用胶头滴管滴加1-2滴紫色石蕊溶液,振荡,观察现象 | 溶液变红 | 猜想三:成立 (填“成立”或“不成立”) |
实验现象:有气泡冒出;
实验结论:猜想三成立
故答案为:(1)猜想三:两种物质反应后稀盐酸过量,溶液显酸性.
(2)①NaOH+HCl=NaCl+H2O
②理由是:若氢氧化钠有剩余,则反应后滴入无色酚酞溶液就不会出现无色的现象,而溶液会变红才对.
③<
④实验步骤:从烧杯中取出少量反应后的溶液于另一支试管中,用胶头滴管滴加1-2滴紫色石蕊溶液,振荡,观察现象;
实验现象:溶液变红
实验结论:猜想三成立
(3)实验步骤:从烧杯中取出少量反应后的溶液于另一支试管中,加入亮丽锌粒,观察现象;
实验现象:有气泡冒出;
实验结论:猜想三成立
点评:本题考查了氢氧化钠与盐酸的中和反应,完成此题,可以依据氢氧化钠与盐酸的性质以及根据化学方程式的计算进行

练习册系列答案
相关题目
下列归纳和推理,你认为不合理的是( )
| A、冰和干冰,组成元素不同-物质分类相同 |
| B、纯碱和烧碱,组成元素不同-物质分类相同 |
| C、金刚石和石墨,组成元素相同,原子排列不同-物理性质不同 |
| D、一氧化碳和二氧化碳,组成元素相同,分子结构不同-化学性质不同 |
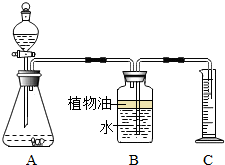 某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.
某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.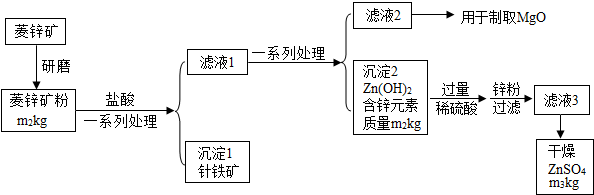
 已知A、B、C三种物质含有同种金属元素,其中A是大理石的主要成分,B为氧化物;D、E、F三种物质含有同种非金属元素,其中F是单质,E是易与血液中血红蛋白结合的有毒气体.它们之间的转化关系如图所示(有些转换关系,反应条件等略去),试回答:
已知A、B、C三种物质含有同种金属元素,其中A是大理石的主要成分,B为氧化物;D、E、F三种物质含有同种非金属元素,其中F是单质,E是易与血液中血红蛋白结合的有毒气体.它们之间的转化关系如图所示(有些转换关系,反应条件等略去),试回答: