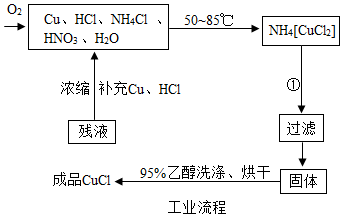
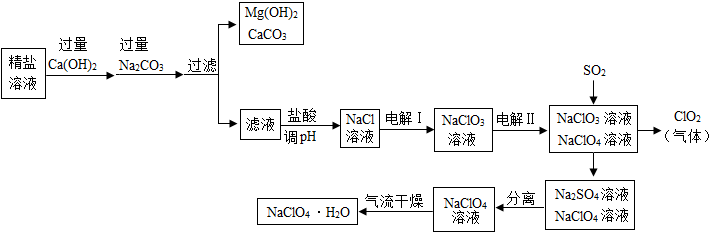
题目内容
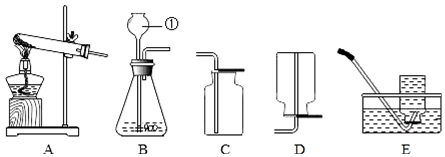
15.根据图示回答下列问题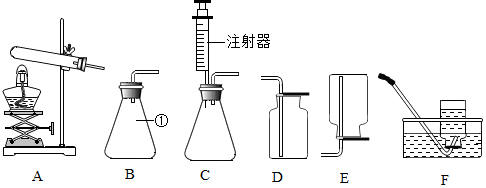
(1)仪器①的名称是锥形瓶.
(2)实验室用A装置制取氧气的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(3)用D装置收集氧气,验证氧气是否收集满的方法是将带火星的木条放在集气瓶口,若木条复燃,说明已集满.
(4)为能得到平稳的氧气流,且收集到纯净的氧气,应选择的发生装置和收集装置是CF.
分析 (1)根据常见的化学仪器的名称,进行分析解答.
(2)实验室用A装置制取氧气,属于固体加热型,试管口没有放一团棉花,采用的加热氯酸钾和二氧化锰混合物的方法,据此进行分析解答.
(3)根据氧气的验满方法,进行分析解答.
(4)要得到平稳的氧气流,采用的是分解过氧化氢溶液的方法,应选用便于控制过氧化氢滴加速率的装置,进行分析解答.
解答 解:(1)仪器①的名称是锥形瓶.
(2)用A装置制取氧气,属于固体加热型,试管口没有放一团棉花,采用的加热氯酸钾和二氧化锰混合物的方法,氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(3)用D装置收集氧气,验证氧气是否收集满的方法是将带火星的木条放在集气瓶口,若木条复燃,说明已集满.
(4)要得到平稳的氧气流,采用的是分解过氧化氢溶液的方法,应选用便于控制过氧化氢滴加速率的装置,选用的发生装置是C,注射器可控制过氧化氢的滴加的快慢,便于控制反应速率,得到平稳的氧气流.用排水法收集的气体比较纯净,应选择的发生装置和收集装置是CF.
故答案为:(1)锥形瓶;(2)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;(3)将带火星的木条放在集气瓶口,若木条复燃,说明已集满;(4)CF.
点评 本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取氧气的反应原理、发生装置和收集装置的选择依据等是正确解答本题的关键.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案
相关题目
8.下列实验操作图示不正确的是( )
| A. |  过滤悬浊液 | B. |  加热液体 | C. |  蒸发溶液 | D. |  倾倒液体 |
6.过氧化钠常用作呼吸面具里的供养剂.兴趣小组取适量过氧化钠粉末,加入到一定量水中,充分反应后,滴入几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色,小组同学对此现象产生好奇.
【提出问题】什么原因导致溶液先变红再褪色
【查阅资料】过氧化钠(Na2O2)是一种浅黄白色颗粒粉末,在空气中吸收水分和二氧化碳,易溶于水,能与水发生反应生成氢氧化钠和过氧化氢.
【猜想与假设】猜想1:甲同学:“可能是无色酚酞溶液变质导致溶液褪色;”
猜想2:乙同学:“可能是生成的过氧化氢使溶液褪色.”
【实验与结论】(1)猜想1,其他同学一致认为不合理,理由是如果是无色酚酞溶液变质,刚开始就不会先变成红色了;
(2)乙同学设计了以下方案进行实验,证明自己的猜想:
【拓展】有同学从资料上得知氢氧化钠溶液浓度过大能导致溶液颜色褪去,他们又进行了以下的实验探究.
【提出问题】什么原因导致溶液先变红再褪色
【查阅资料】过氧化钠(Na2O2)是一种浅黄白色颗粒粉末,在空气中吸收水分和二氧化碳,易溶于水,能与水发生反应生成氢氧化钠和过氧化氢.
【猜想与假设】猜想1:甲同学:“可能是无色酚酞溶液变质导致溶液褪色;”
猜想2:乙同学:“可能是生成的过氧化氢使溶液褪色.”
【实验与结论】(1)猜想1,其他同学一致认为不合理,理由是如果是无色酚酞溶液变质,刚开始就不会先变成红色了;
(2)乙同学设计了以下方案进行实验,证明自己的猜想:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1-2滴酚酞试液,变红后,往试管中滴加过氧化氢溶液,观察现象. | 溶液仍然为红色 | 不是过氧化氢使溶液褪色 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量原溶液于试管中,加入适量的水. | 溶液变成红色 | 氢氧化钠溶液浓度过大,导致溶液颜色褪去 |
10.“侯氏制碱法”首先得到的碳酸氢钠,然后将碳酸氢钠加热分解得到产品碳酸钠,反应的化学方程式为:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.碳酸钠置露在空气中能与空气中的二氧化碳和水反应生成碳酸氢钠:Na2CO3+CO2+H2O═2NaHCO3.某中学化学学习小组对一瓶开启后久置的碳酸钠是否变质及变质程度进行探究.
【提出问题】假设Ⅰ:完全变质;假设Ⅱ:没有变质;假设Ⅲ:部分变质.
【查阅资料】碳酸氢钠溶液不与CaCl2溶液反应
【实验探究】
【交流反思】欲除去Na2CO3变质后的杂质,最合适的方法是将样品充分加热.
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.碳酸钠置露在空气中能与空气中的二氧化碳和水反应生成碳酸氢钠:Na2CO3+CO2+H2O═2NaHCO3.某中学化学学习小组对一瓶开启后久置的碳酸钠是否变质及变质程度进行探究.
【提出问题】假设Ⅰ:完全变质;假设Ⅱ:没有变质;假设Ⅲ:部分变质.
【查阅资料】碳酸氢钠溶液不与CaCl2溶液反应
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品于试管中,加水溶解后再加入少量CaCl2溶液 | 产生白色沉淀 | 假设Ⅱ不成立,反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl. |
| 取少量样品于试管中,用导管连接后固定在铁架台上,导管的另一端插入澄清石灰水中.加热样品 | 有气体产生,澄清的石灰水变浑浊 | 假设Ⅰ不成立.则样品的成分是Na2CO3和NaHCO3. |
4.硫酸镁在工农业以及医疗上有广泛应用,其溶解度如表所示.则下列说法正确的是 ( )
| 温度/℃ | 10 | 30 | 50 | 70 | 90 |
| 溶解度/g | 27.7 | 39.3 | 49.0 | 54.1 | 51.1 |
| A. | 硫酸镁的溶解度随温度升高而增大 | |
| B. | 10℃时,27.7g硫酸镁和72.3g水可配制成质量分数为27.7%的硫酸镁溶液 | |
| C. | 50℃时,100g的硫酸镁饱和溶液中溶质和溶剂的质量比为49:100 | |
| D. | 70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数增大 |
5.下列数据是人体内一些液体的正常pH范围,其中酸性最强的是( )
| A. | 尿液4.7~8.4 | B. | 唾液6.6~7.1 | C. | 血浆7.35~7.45 | D. | 胃液0.9~1.5 |