题目内容
7.(1)化学实验安全第一,下列实验要特别注意安全的是C(填序号).A、取用大理石 B、称量粗盐 C、稀释浓硫酸 D、研碎胆矾
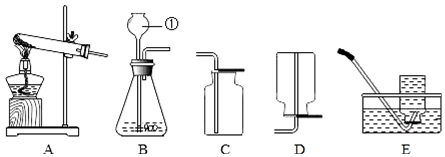
(2)写出标号①的仪器名称长颈漏斗.
(3)氨气(NH3)是一种无色有刺激性气味,极易溶于水的气体.实验室常用氯化铵晶体和氢氧化钙粉末混合加热来制取氨气.写出制取氨气的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;选取上述A和D装置制取和收集某种气体,可推知该气体的物理性质是密度比空气小,制取气体的反应一定是D(填序号).
A.不需要加热B.需要催化剂C,制取氧气的反应D.反应物都是固体.
分析 (1)根据实验存在的危险性来分析;
(2)熟记仪器的名称;
(3)根据反应的原理以及化学方程式的书写方法、根据收集方法确定氨气的物理性质,根据制取装置确定反应物的状态与反应的条件.
解答 解:(1)如果水加入浓硫酸时,水的密度小于浓硫酸的密度,在浓硫酸的上面,浓硫酸溶解放出大热量,使水沸腾,液体就会喷出伤人,因此,稀释浓硫酸时,一定要把浓硫酸慢慢倒入水中,并用玻璃棒不断搅拌,使产生的热量及时散发;故填:C;
(2)标号①的仪器名称是长颈漏斗;故填:长颈漏斗;
(3)实验室常用氯化铵晶体和氢氧化钙粉末混合加热来制取氨气,因此需要加热;氯化铵和氢氧化钙在加热的条件下生成氯化钙和氨气和水,化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;用向下排空气法来收集氨气,这说明氨气的密度比空气小,用A装置来制取气体,说明反应物是固体加热制取气体,但不能说明一定使用了催化剂;不但可以制取氧气,还可以制取气体气体;故填:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;密度比空气小;D.
点评 掌握常见实验的注意事项、仪器的使用方法以及制取和收集气体装置的选择依据是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列各组离子在水溶液中能大量共存的是( )
| A. | Cu2+、Na+、NO3-、OH- | B. | H+、K+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、OH-、SO42- | D. | Na+、Ca2+、NO3-、Cl- |
18.如表是部分碱、酸、盐的溶解性表(20℃)中的一部分,据此判断下列有关①处物质的说法错误的是( )
部分碱、酸、盐的溶解性表(20℃)
部分碱、酸、盐的溶解性表(20℃)
| 氢氧根或酸根 溶解性 氢离子或金属离子 | OH- | CO32- |
| Na+ | 溶 | ① |
| Ca2+ | 微 | 不 |
| A. | ①处物质是Na2CO3 | B. | ①处物质可溶于水 | ||
| C. | ①处物质可用作洗涤剂 | D. | ①处物质属于碱 |
12.下列图象表示的对应关系正确的是( )
| A. | 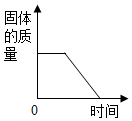 图表示煅烧石灰石 | B. | 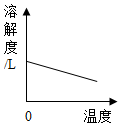 图表示CO2在水中的溶解性 | ||
| C. | 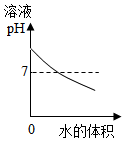 图表示向NaOH溶液中加水 | D. | 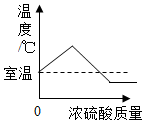 图表示将浓硫酸加入水中 |
19. 实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如下图),化学小组的同学经过寻问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:
实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如下图),化学小组的同学经过寻问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:
【进行猜想】
猜想I:原溶液的溶质是NaCl;
猜想II:原溶液的溶质是NaOH;
猜想III:原溶液的溶质是Na2CO3;
猜想IV:原溶液的溶质是NaHCO3.
【查阅资料】
常温下,有关物质的相关信息如下表:
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为碳酸氢钠的饱和溶液溶质质量分数在该温度下不能达到10%.
【进行实验】
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是NaCl.
(2)同学们另取样品又进行了如下实验,实验过程如下:

①生成白色沉淀A的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl.
②通过实验可以判断样品无色溶液中含有的溶质有NaOH、Na2CO3
【获得结论】
实验完成后,最终得到的结论:原瓶中的溶质是NaOH,且已变质.
 实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如下图),化学小组的同学经过寻问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:
实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如下图),化学小组的同学经过寻问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:【进行猜想】
猜想I:原溶液的溶质是NaCl;
猜想II:原溶液的溶质是NaOH;
猜想III:原溶液的溶质是Na2CO3;
猜想IV:原溶液的溶质是NaHCO3.
【查阅资料】
常温下,有关物质的相关信息如下表:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
| 常温下稀溶液的pH | 7 | 13 | 11 | 9 |
【进行实验】
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是NaCl.
(2)同学们另取样品又进行了如下实验,实验过程如下:

①生成白色沉淀A的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl.
②通过实验可以判断样品无色溶液中含有的溶质有NaOH、Na2CO3
【获得结论】
实验完成后,最终得到的结论:原瓶中的溶质是NaOH,且已变质.
17. 如图所示:装置气密性良好,广口瓶内装有某种固体,向其中滴加某种液体后,U形管内液面a低于b,不符合上述实验现象的一组试剂是( )
如图所示:装置气密性良好,广口瓶内装有某种固体,向其中滴加某种液体后,U形管内液面a低于b,不符合上述实验现象的一组试剂是( )
 如图所示:装置气密性良好,广口瓶内装有某种固体,向其中滴加某种液体后,U形管内液面a低于b,不符合上述实验现象的一组试剂是( )
如图所示:装置气密性良好,广口瓶内装有某种固体,向其中滴加某种液体后,U形管内液面a低于b,不符合上述实验现象的一组试剂是( )| A. | 生石灰和水 | B. | 铁粉和稀盐酸 | C. | 硝酸铵和水 | D. | 纯碱和稀盐酸 |

 如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题.
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题.