题目内容
3.氯化亚铜在工业上应用广泛.氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇.如图是工业制取氯化亚铜的生产流程图.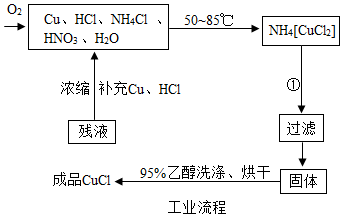
(1)已知反应①获得CuCl发生的是分解反应,写出该反应的化学方程式NH4[CuCl2]═CuCl+NH4Cl,
(2)用95%乙醇代替蒸馏水洗涤的主要目的是防止氯化亚铜溶于水.
(3)除水以外流程中可以循环利用的物质有NH4Cl.
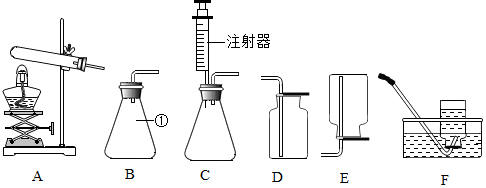
(4)实验室可以用如图甲装置制备CuCl:
实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水图乙中的A、B、C三套装置均有足量的氧气生成

①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择图乙中的B装置(填字母序号A、B、C).
②按要求在反应装置甲中放入指定的实验药品后,发现温度计显示反应液温度明显低于室温,原因可能是氯化铵溶于水吸热.
分析 (1)已知反应①获得CuCl发生的是分解反应,则NH4[CuCl2]分解生成氯化亚铜和氯化铵;
(2)用95%乙醇代替蒸馏水洗涤时,由于氯化亚铜微溶于水,不溶于醇,因此可以防止氯化亚铜溶于水而造成产品损失;
(3)根据工艺流程可以判断循环利用的物质;
(4)不同的实验装置,优缺点不同;
按要求在反应装置甲中放入指定的实验药品后,发现温度计显示反应液温度明显低于室温,原因可能是氯化铵溶于水吸收热量.
解答 解:(1)已知反应①获得CuCl发生的是分解反应,则NH4[CuCl2]分解生成氯化亚铜和氯化铵,反应的化学方程式为:NH4[CuCl2]═CuCl+NH4Cl.
故填:NH4[CuCl2]═CuCl+NH4Cl.
(2)氯化亚铜微溶于水,不溶于醇,因此用95%乙醇代替蒸馏水洗涤的主要目的是防止氯化亚铜溶于水.
故填:防止氯化亚铜溶于水.
(3)由工艺流程可知,反应生成的氯化铵随着残夜又进入反应容器中,因此除水以外流程中可以循环利用的物质有NH4Cl.
故填:NH4Cl.
(4)①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择图乙中的B,这是因为B装置通过分液漏斗可以控制水的流量,从而可以控制反应速率,同时根据浓硫酸中产生气泡的速率可以判断产生氧气的速率.
故选:B.
②按要求在反应装置甲中放入指定的实验药品后,发现温度计显示反应液温度明显低于室温,原因可能是氯化铵溶于水吸热.
故填:氯化铵溶于水吸热.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
16.类比推理在化学学习和科学研究中有重要意义.下列类比推理正确的是( )
| A. | NaOH和KOH都是强碱,两者都能与硫酸铜溶液反应生成蓝色沉淀 | |
| B. | N2和O2都是非金属单质,两者的化学性质都非常活泼 | |
| C. | 盐酸和硫酸都是强酸,两者都易挥发 | |
| D. | CaO和Fe2O3都是金属氧化物,两者都能与水反应生成碱 |
17.中和反应在生活中有广泛应用.下列应用不属于中和反应的是( )
| A. | 用盐酸除铁锈 | |
| B. | 服用含有氢氧化镁的药物治疗胃酸过多 | |
| C. | 用熟石灰改良酸性土壤 | |
| D. | 用硫酸处理印染厂含碱废水 |
11.不停地加热一杯不饱和硝酸钾溶液,蒸发溶剂,以下关于溶液发生的变化正确的是( )
| A. | 整个过程中,硝酸钾溶液的质量分数不断增大 | |
| B. | 整个过程中,硝酸钾的溶解度不断增大 | |
| C. | 整个过程中,始终不断有硝酸钾晶体析出 | |
| D. | 析出晶体后,温度不变,加热相同时间析出的晶体质量相同 |
18.如表是部分碱、酸、盐的溶解性表(20℃)中的一部分,据此判断下列有关①处物质的说法错误的是( )
部分碱、酸、盐的溶解性表(20℃)
部分碱、酸、盐的溶解性表(20℃)
| 氢氧根或酸根 溶解性 氢离子或金属离子 | OH- | CO32- |
| Na+ | 溶 | ① |
| Ca2+ | 微 | 不 |
| A. | ①处物质是Na2CO3 | B. | ①处物质可溶于水 | ||
| C. | ①处物质可用作洗涤剂 | D. | ①处物质属于碱 |
8.下列各组物质可按溶解、过滤、蒸发的操作顺序分离的是( )
| A. | 氧化铜和木炭粉 | B. | 食盐和泥沙 | C. | 水和酒精 | D. | 氯化银和硫酸钡 |
12.下列图象表示的对应关系正确的是( )
| A. |  图表示煅烧石灰石 | B. |  图表示CO2在水中的溶解性 | ||
| C. |  图表示向NaOH溶液中加水 | D. |  图表示将浓硫酸加入水中 |