题目内容
4.如图为实验室制取气体的装置图,回答下列问题:
(1)用高锰酸钾制取氧气时选用的发生装置为A(填编号),反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.实验时,还应在试管口放棉花团,以防止加热时高锰酸钾粉末进入导管.
(2)实验室制取二氧化碳的化学方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O.用B装置制得的CO2气体可能含有少量水蒸气,欲进行干燥,可选下列物质中的B(填序号).
A.氢氧化钠溶液 B.浓硫酸 C.氯化钠溶液
(3)硫化氢(H2S)是一种有毒气体,其密度比空气大,且能溶于水,水溶液呈酸性.实验室通常用硫化亚铁(FeS)与稀硫酸在常温下通过复分解反应制得.小华同学设计的实验装置为BD组合,你认为此装置是否合理不合理(填“合理”或“不合理”),理由是H2S气体有毒,有部分H2S气体外逸污染空气.
分析 (1)用高锰酸钾制取氧气时,需要加热,所以选取A装置;并据反应原理和注意事项解答;
(2)根据制取二氧化碳的反应原理书写方程式;常用浓硫酸干燥二氧化碳气体;
(3)硫化亚铁(FeS)与稀硫酸在常温下反应生成硫化氢,可以选B作发生装置;但是硫化氢(H2S)是有毒气体,不能用D收集,应用F装置.因为:硫化氢(H2S)是有毒气体,会外逸污染空气.
解答 解:(1)用高锰酸钾制取氧气时,需要加热,所以选取A装置,反应方程式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,试管口要加棉花,防止加热时高锰酸钾粉末进入导管;
(2)实验室制取二氧化碳用大理石和稀盐酸,反应方程式是:CaCO3+2HCl═CaCl2+CO2↑+H2O;浓硫酸具有极强的吸水性,可用来干燥二氧化碳气体;
(3)硫化氢(H2S)是用硫化亚铁(FeS)与稀硫酸在常温下通过复分解反应制得.可用B装置做发生装置;硫化氢(H2S)虽密度比空气大,但是它是一种有毒气体,不能在敞口的集气瓶中收集,所以不能用D装置做收集装置.故BD装置不合理;
故答案为:(1)A;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;一团棉花;
(2)CaCO3+2HCl═CaCl2+CO2↑+H2O;B;
(3)不合理;H2S气体有毒,有部分H2S气体外逸污染空气.
点评 本题主要考查常用气体的发生装置和收集装置的选取方法以及注意事项;并且要正确书写化学方程式;会利用题目中的信息处理问题.

练习册系列答案
相关题目
12.如图实验基本操作错误的是( )
| A. |  加热液体 | B. |  稀释浓硫酸 | ||
| C. |  测定溶液pH | D. |  向试管内倾倒液体 |
19.某同学为测定10g某赤铁矿石中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了如图所示的装置,进行有关的实验探究(提示:氢气也有一氧化碳相似的化学性质3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O;杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:得到数据如表:

(1)实验前先通一会氢气原因排出装置内的空气,防止加热时产生爆炸;试验中观察到的实验现象为红色粉末变黑;实验结束时先停止加热后停止通入氢气,原因防止生成的铁被氧化.
(2)请计算该赤铁矿石样品中氧化铁的质量分数.80%
(3)该实验还可测定组成水中各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为[(296.8g-294.1g)-(84.3g-81.9g)]:(84.3g-81.9g)(只列式,不计算);若玻璃管中的氧化铁没有完全反应,则求得水中氢、氧元素的质量比会不变(选填“偏大”、“偏小”或“不变”).

| 装置 | B | C |
| 反应前质量 | 84.3g | 294.1g |
| 反应后质量 | 81.9g | 296.8g |
(2)请计算该赤铁矿石样品中氧化铁的质量分数.80%
(3)该实验还可测定组成水中各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为[(296.8g-294.1g)-(84.3g-81.9g)]:(84.3g-81.9g)(只列式,不计算);若玻璃管中的氧化铁没有完全反应,则求得水中氢、氧元素的质量比会不变(选填“偏大”、“偏小”或“不变”).
 某星期日,石门中学初三(二)班化学兴趣小组的同学到石家庄市西郊的山上采集到一种石灰石,带回学校后,在实验室里进行如下实验:取样品10g放入试管中,向试管里逐滴滴入稀盐酸,当不再有气体产生时,恰好用去稀盐酸36.5g.其反应进程如图所示.
某星期日,石门中学初三(二)班化学兴趣小组的同学到石家庄市西郊的山上采集到一种石灰石,带回学校后,在实验室里进行如下实验:取样品10g放入试管中,向试管里逐滴滴入稀盐酸,当不再有气体产生时,恰好用去稀盐酸36.5g.其反应进程如图所示.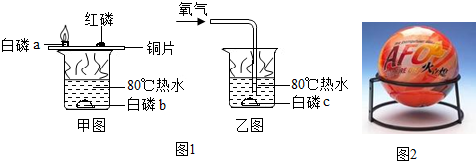
 Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH═A↓+NaCl,则A沉淀是.由于Fe(OH)2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,因而在溶液中较难制得纯净的Fe(OH)2.若按照常规的正确方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀现象,只能看到灰绿色沉淀.
Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH═A↓+NaCl,则A沉淀是.由于Fe(OH)2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,因而在溶液中较难制得纯净的Fe(OH)2.若按照常规的正确方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀现象,只能看到灰绿色沉淀. 用如图所示装置进行″探究空气中氧气含量″的实验.实验步骤如下:①先用止水夹夹紧橡皮管;②点燃燃烧匙里的红磷;③迅速将燃烧匙插入集气瓶,并塞紧塞子;④燃烧完毕并冷却后,打开止水夹.
用如图所示装置进行″探究空气中氧气含量″的实验.实验步骤如下:①先用止水夹夹紧橡皮管;②点燃燃烧匙里的红磷;③迅速将燃烧匙插入集气瓶,并塞紧塞子;④燃烧完毕并冷却后,打开止水夹. 某实验小组同学设计了如图装置模拟氢气探空气球(装置中气球固定在矿泉水瓶上).将气球中的镁条加入到硫酸溶液中,恰好完全反应.
某实验小组同学设计了如图装置模拟氢气探空气球(装置中气球固定在矿泉水瓶上).将气球中的镁条加入到硫酸溶液中,恰好完全反应.