题目内容
19.某同学为测定10g某赤铁矿石中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了如图所示的装置,进行有关的实验探究(提示:氢气也有一氧化碳相似的化学性质3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O;杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:得到数据如表: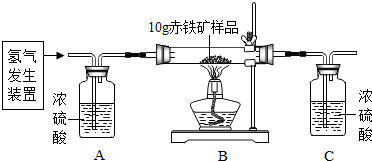
| 装置 | B | C |
| 反应前质量 | 84.3g | 294.1g |
| 反应后质量 | 81.9g | 296.8g |
(2)请计算该赤铁矿石样品中氧化铁的质量分数.80%
(3)该实验还可测定组成水中各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为[(296.8g-294.1g)-(84.3g-81.9g)]:(84.3g-81.9g)(只列式,不计算);若玻璃管中的氧化铁没有完全反应,则求得水中氢、氧元素的质量比会不变(选填“偏大”、“偏小”或“不变”).
分析 (1)根据氢气还原氧化铁的现象以及注意事项进行分析解答;
(2)根据反应生成水的质量,可以计算氧化铁的质量,进一步可以计算该赤铁矿石样品中氧化铁的质量分数;
(3)反应生成水的质量和氧化铁中氧元素的质量差即为水中氢元素的质量.
解答 解:(1)氢气具有可燃性,不纯时点燃或是加热可能会产生爆炸,故实验前需要通入一会氢气,以排出装置内的空气,防止加热时产生爆炸;氢气还原氧化铁会生成铁和水,故会观察到玻璃管内红色粉末变为黑色;实验结束时要继续通入氢气直到玻璃管冷却,以防止生成的铁被氧化,故填:排出装置内的空气,防止加热时产生爆炸;红色粉末变黑;停止加热;停止通入氢气;防止生成的铁被氧化;
(2)设样品中氧化铁的质量为x,
生成水的质量为296.8g-294.1g=2.7g,
3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O,
160 54
x 2.7g
$\frac{160}{54}=\frac{x}{2.7g}$,
x=8g,
赤铁矿石样品中氧化铁的质量分数为:$\frac{8g}{10g}$×100%=80%,
故填:80%;
(2)水中氢、氧元素的质量比为:[(296.8g-294.1g)-(84.3g-81.9g)]:(84.3g-81.9g);
无论玻璃管中的氧化铁是否完全反应,都不影响水中氢元素和氧元素的质量比,因此若玻璃管中的氧化铁没有完全反应,则求得水中氢、氧元素的质量比不变.
故填:[(296.8g-294.1g)-(84.3g-81.9g)]:(84.3g-81.9g);不变.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

| A. | 80g | B. | 90g | C. | 100g | D. | 110g |
| A. | 100mL溶质质量分数为40%(密度为1.3g/mL)的硫酸溶液中含硫酸的质量为40g | |
| B. | 30℃时,100g饱和KCl溶液中含 27gKCl,则30C,KCl的溶解度不等于27g | |
| C. | 30℃时100g水中最多溶解37gKCl,则30gKCl饱和溶液中溶质的质量分数为37% | |
| D. | 20℃时硝酸钾溶液的质量分数为5%,可理解为100g硝酸钾溶液中含硝酸钾5g |
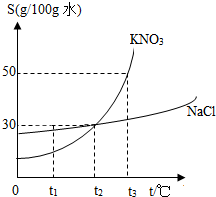 如图是A、B两种固体物质的溶解度曲线.从图中可获得大量信息.
如图是A、B两种固体物质的溶解度曲线.从图中可获得大量信息.