题目内容
3.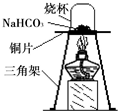 某化学兴趣小组的同学发现发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致,发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
某化学兴趣小组的同学发现发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致,发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈碱性.
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是质量守恒定律.
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表(只要求填写其中一行.若两行都写,按第一行计分):
| 实 验 操 作 | 预期实验现象 | 结 论 |
| 向固体中加入足量的稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3,而不是NaOH. |
| 向固体中加入足量的稀盐酸 | 没有气泡产生 | 固体产物是NaOH,而不是Na2CO3. |
【拓展应用】
碳酸氢钠、碳酸钙、氢氧化镁等常用于制作抗酸药,用来治疗胃酸过多.但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠、碳酸钙等碳酸盐,其原因是碳酸盐与胃酸(或HCl)反应生成二氧化碳气体,可能会加重胃溃疡病情.
分析 溶液的pH大于7时,显碱性;
氢氧化钙和二氧化碳反应能生成碳酸钙和水;
反应前后元素的种类不变,原子的种类和个数不变;
碳酸钠和稀盐酸反应能生成氯化钠、水和二氧化碳,氢氧化钠稀盐酸反应能生成氯化钠和水.
碳酸氢钠在加热条件下反应生成碳酸钠、水和二氧化碳.
解答 解:实验一:用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈碱性.故填:碱.
实验二:(1)加热一段时间后,观察到烧杯内壁有水珠.故填:水珠.
(2)氢氧化钙和二氧化碳反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)①兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3的依据是质量守恒定律.故填:质量守恒定律.
②碳酸钠和稀盐酸反应能生成氯化钠、水和二氧化碳,氢氧化钠稀盐酸反应能生成氯化钠和水.
| 实 验 操 作 | 预期现象 | 结 论 |
| 向固体中加入足量的稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3,而不是NaOH |
| 向固体中加入足量的稀盐酸 | 没有气泡产生 | 固体产物是NaOH,而不是Na2CO3 |
该反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(4)碳酸盐与酸反应能生成二氧化碳气体,生成的二氧化碳使胃中气压增大,可能引起胃穿孔,加大病情,所以本题答案为:碳酸盐与胃酸(或HCl)反应生成二氧化碳气体,可能会加重胃溃疡病情.
答案:
实验一:碱;
实验二:(1)水珠;
(2)Ca(OH)2+CO2=CaCO3↓+H2O;
(3)①质量守恒定律.
②
| 实 验 操 作 | 预期现象 | 结 论 |
| 向固体中加入足量的稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3,而不是NaOH |
| 向固体中加入足量的稀盐酸 | 没有气泡产生 | 固体产物是NaOH,而不是Na2CO3 |
(4)碳酸盐与胃酸(或HCl)反应生成二氧化碳气体,可能会加重胃溃疡病情.
点评 本题主要考查物质的酸碱性和化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
8.地壳中含量最高的非金属元素是( )
| A. | 铁 | B. | 铝 | C. | 氧 | D. | 硅 |
15.以美国为首的北约对南斯拉夫联盟共和国轰炸中使用了“石墨炸弹”,用来破坏输变电系统.“石墨炸弹”的破坏性主要利用了石墨( )
| A. | 质软 | B. | 能导电 | C. | 有滑腻感 | D. | 有金属光泽 |
 .
.
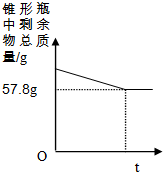 某同学在实验室测定某石灰石样品中碳酸钙的质量分数,他取了10克样品放入锥形瓶中,另取了50克足量的稀盐酸倒入,待充分反应后,锥形瓶中剩余物总质量和时间关系如图所示,求:
某同学在实验室测定某石灰石样品中碳酸钙的质量分数,他取了10克样品放入锥形瓶中,另取了50克足量的稀盐酸倒入,待充分反应后,锥形瓶中剩余物总质量和时间关系如图所示,求: 归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质(如图所示,连线表示相互 反应).
归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质(如图所示,连线表示相互 反应).