题目内容
14.草木炭是一种钾肥,它的主要成分是碳酸钾.我县科学技术协会的检测人员为了粗略地测定草木炭中碳酸钾的质量分数,进行如下实验步骤:①称取草木炭样品20g;
②取100g稀盐酸;
③将称取的草木炭样品全部投到盛有100g稀盐酸的烧杯中,发现它们恰好完全反应(草木炭中除碳酸钾外,杂质不与稀盐酸反应,也不溶于水).
④将烧杯中的物质进行过滤、洗涤、烘干,得到6.2g固体物质.
根据以上实验数据,请计算:
(1)草木炭中碳酸钾的质量分数是69%.
(2)稀盐酸中溶质的质量分数.
(化学方程式是:K2CO3+2HCl═2KCl+CO2↑+H2O)
分析 根据将烧杯中的物质进行过滤、洗涤、烘干,得到6.2g固体物质为不反应的杂质的质量,草木炭中碳酸钾的质量为20g-6.2g=13.8g;根据碳酸钾的质量求出氯化氢的质量.
解答 解:
(1)碳酸钾和盐酸反应生成氯化钾、水和二氧化碳气体,将烧杯中的物质进行过滤、洗涤、烘干,得到6.2g固体物质为不反应的杂质的质量,草木炭中碳酸钾的质量为20g-6.2g=13.8g;
草木炭中碳酸钾的质量分数是:$\frac{13.8g}{20g}$×100%=69%;
(2)设碳酸钾的质量为x
K2CO3+2HCl═2KCl+H2O+CO2↑
138 73
13.8g x
$\frac{138}{13.8g}=\frac{73}{x}$
x=7.3g
稀盐酸中溶质的质量分数=$\frac{7.3g}{100g}×$100%=7.3%
答案:
(1)69%;
(2)稀盐酸中溶质的质量分数为7.3%.
点评 本题主要考查学生运用化学方程式和化学式的相关计算,并考查综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
2.下列图示实验操作中,正确的是( )
| A. |  读液体体积 | B. |  点燃酒精灯 | C. |  检查气密性 | D. |  过滤 |
19.下列过程,属于化学变化的是( )
| A. | 分离液态空气制氧气 | B. | 石油分馏 | ||
| C. | 石油裂解 | D. | 通过蒸馏制取纯净水 |
3. 某化学兴趣小组的同学发现发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致,发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
某化学兴趣小组的同学发现发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致,发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈碱性.
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
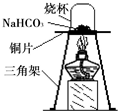
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是质量守恒定律.
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表(只要求填写其中一行.若两行都写,按第一行计分):
【小结】NaHCO3受热发生变化的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
【拓展应用】
碳酸氢钠、碳酸钙、氢氧化镁等常用于制作抗酸药,用来治疗胃酸过多.但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠、碳酸钙等碳酸盐,其原因是碳酸盐与胃酸(或HCl)反应生成二氧化碳气体,可能会加重胃溃疡病情.
 某化学兴趣小组的同学发现发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致,发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
某化学兴趣小组的同学发现发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致,发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈碱性.
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是质量守恒定律.
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表(只要求填写其中一行.若两行都写,按第一行计分):
| 实 验 操 作 | 预期实验现象 | 结 论 |
| 向固体中加入足量的稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3,而不是NaOH. |
| 向固体中加入足量的稀盐酸 | 没有气泡产生 | 固体产物是NaOH,而不是Na2CO3. |
【拓展应用】
碳酸氢钠、碳酸钙、氢氧化镁等常用于制作抗酸药,用来治疗胃酸过多.但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠、碳酸钙等碳酸盐,其原因是碳酸盐与胃酸(或HCl)反应生成二氧化碳气体,可能会加重胃溃疡病情.
4.下列基本操作正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
 硝酸钾在工农业生产中具有广泛用途.
硝酸钾在工农业生产中具有广泛用途.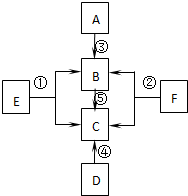 A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,它们之间的转化关系如右图所示((图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).).
A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,它们之间的转化关系如右图所示((图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).).