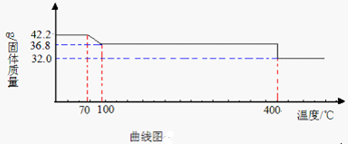
题目内容
11.分别用以下三组物质比较锌和铜的金属活动性:①Zn、Cu、稀硫酸;②Zn、Cu、MgSO4溶液;③Zn、CuSO4溶液.仅用组内物质就能够直接达到目的是( )| A. | 只有① | B. | 只有②③ | C. | 只有①③ | D. | ①②③ |
分析 根据金属与酸反应,金属与盐反应的条件考虑,金属能与酸反应说明排在了氢的前面,金属能与盐溶液反应,说明排在了盐中金属的前面,否则排在了盐中金属的后面.
解答 解:①Zn与硫酸反应能放出氢气,说明锌排在了氢的前面,Cu与硫酸不反应说明铜排在了氢的后面,所以锌比铜活泼,所以能比较;
②Zn和Cu都不能与MgSO4溶液反应,只能说明Zn和Cu都排在了镁的后面,但比较不出锌和铜的活泼性;
③Zn能与CuSO4溶液反应生成铜和硫酸锌,说明锌排在了铜的前面,可以比较.所以:
由上述分析可知,C正确;A、B、D错误.
故选C.
点评 氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1. 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关; ②可能与锌的形状有关.
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟).
(1)锌与硫酸反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑.
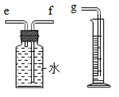
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:氢气→e f g(填导管口序号).
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
【得出结论】依据上表得出的结论是相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积).
请解释锌与稀硫酸反应由快变慢的原因随着硫酸被消耗,硫酸溶质质量分数变小,所以反应速度由快变慢.
(5)锌与硫酸反应的快慢可能还会受温度因素影响,如果用实验验证该因素对反应快慢的影响,应该控制温度因素不同,而其他因素则相同.
 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关; ②可能与锌的形状有关.
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟).
| 编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| 1 | 20% | 锌粒 | 31.7 |
| 2 | 20% | 锌片 | 50.9 |
| 3 | 30% | 锌粒 | 61.7 |
| 4 | 30% | 锌片 | 79.9 |
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:氢气→e f g(填导管口序号).
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
【得出结论】依据上表得出的结论是相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积).
| 时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
(5)锌与硫酸反应的快慢可能还会受温度因素影响,如果用实验验证该因素对反应快慢的影响,应该控制温度因素不同,而其他因素则相同.
2.下列化学方程式书写正确的是( )
| A. | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO2 | B. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | NH4HCO3$\frac{\underline{\;加热\;}}{\;}$NH3↑+CO2↑+H2O |
3.我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如下所示),反应原理为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3(析出),促进了世界制碱技术的发展.下列说法正确的是( )
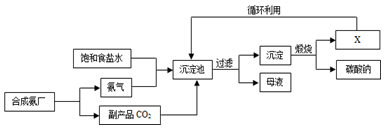

| A. | 沉淀池中的反应物共含有4种元素 | |
| B. | 通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 | |
| C. | 图中X可能是氨气 | |
| D. | 过滤得到的“母液”中一定只含有两种溶质 |
1.鉴别O2、CO和CO2三种无色气体,可行的简便方法是( )
| A. | 将气体分别通入澄清石灰水 | B. | 将气体分别通入石蕊试液 | ||
| C. | 试验三种气体在水中的溶解性 | D. | 将燃着的木条分别伸入三个集气瓶 |