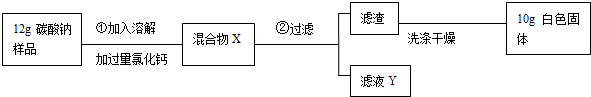
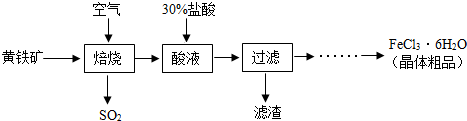
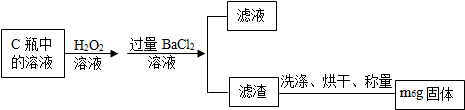
题目内容
10.经科学测定,一个质子和一个中子的质量大约(填“相等”或“不等”)相等,都约等于一个电子质量的1836倍,因此原子的质量主要集中在原子核上.分析 一个质子和一个中子的质量大约相等;都约等于一个电子质量的1836倍;因此原子的质量主要集中在原子核上.
解答 解:一个质子和一个中子的质量大约相等;都约等于一个电子质量的1836倍;因此原子的质量主要集中在原子核上.
答案:相等,1836;原子核.
点评 本题主要考查了微观粒子的构成及其特征等方面的内容,难度较小.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
5.钛(Ti)广泛用于航空、航天等领域.生产钛的过程中存在反应:TiCl4+2Mg═Ti+2MgCl2.这一反应的反应类型为( )
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
15.下列物质属于氧化物的是( )
| A. | 氧气 | B. | 二氧化碳 | C. | 铁粉 | D. | 高锰酸钾 |
2.下列关于元素的说法中正确的是( )
| A. | 具有相同核电荷数(即核内质子数)的一类原子的总称 | |
| B. | 是相对原子质量相同的一类原子的总称 | |
| C. | 是具有相同电子数的一类原子的总称 | |
| D. | 是具有相同中子数的一类原子的总称 |
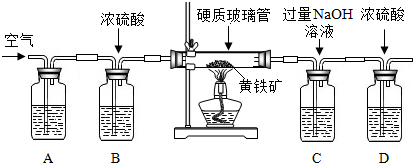
19.钢铁工业是国家工业的基础. 某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究.
[设计实验]
用一氧化碳还原纯净的氧化铁粉末,实验装置如图.

[进行实验]
该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
[分析与讨论]
本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料.
[查阅资料]
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
[实验与猜想]
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁.
②进行猜想:黑色固体粉末可能
a.全部为铁 b.全部是四氧化三铁 c铁与四氧化三铁的混合物.
[得出结论]
通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)四氧化三铁.
[反思与评价]
①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.
②实验装置图中采用虚线框内的装置,其作用有A、B.
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.
[设计实验]
用一氧化碳还原纯净的氧化铁粉末,实验装置如图.

[进行实验]
该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料.
[查阅资料]
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
[实验与猜想]
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁.
②进行猜想:黑色固体粉末可能
a.全部为铁 b.全部是四氧化三铁 c铁与四氧化三铁的混合物.
[得出结论]
通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)四氧化三铁.
[反思与评价]
①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.
②实验装置图中采用虚线框内的装置,其作用有A、B.
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.
 在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的样品Na2CO3中混有少量NaHCO3.为了测定样品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示.
在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的样品Na2CO3中混有少量NaHCO3.为了测定样品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示.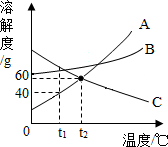 如图A、B、C三种固体物质的溶解度曲线.
如图A、B、C三种固体物质的溶解度曲线.