题目内容
11.海水主要含有NaCl、MgCl2等可以利用的物质,综合利用海水和贝壳(主要成分是碳酸钙)为原料来取备金属镁的流程如图所示: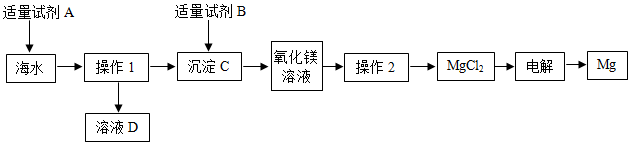
请回答:
(1)写出以贝壳为原料制得试剂A的化学方程式CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O═Ca(OH)2,在海水中加入试剂A的作用是把镁离子转化成氢氧化镁沉淀.
(2)若在实验室进行操作1,需要用到的玻璃仪器除漏斗外,还有烧杯和玻璃棒.
(3)试剂B与沉淀C发生反应的化学方程式是Mg(OH)2+2HCl═MgCl2+2H2O,判断加入试剂B“适量”的现象是沉淀刚好消失.
(4)用化学用语表示溶液D中含有的粒子:H2O、Ca2+、Na+、Cl-.
分析 (1)试剂A是氢氧化钙,贝壳主要成分是碳酸钙,高温条件下碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙;
氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙;
(2)操作1是过滤,过滤需要用到的玻璃仪器除漏斗外,还有烧杯和玻璃棒;
(3)试剂B是稀盐酸,沉淀C是氢氧化镁,稀盐酸和氢氧化镁反应生成氯化镁和水;
(4)溶液D中含有的粒子有水分子、钙离子、钠离子、氯离子.
解答 解:(1)高温条件下碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O═Ca(OH)2;
在海水中加入试剂A的作用是把镁离子转化成氢氧化镁沉淀.
故填:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O═Ca(OH)2;把镁离子转化成氢氧化镁沉淀.
(2)若在实验室进行操作1(过滤),需要用到的玻璃仪器除漏斗外,还有烧杯和玻璃棒.
故填:烧杯和玻璃棒.
(3)试剂B是稀盐酸,沉淀C是氢氧化镁,稀盐酸和氢氧化镁反应生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O;
判断加入试剂B“适量”的现象是沉淀刚好消失.
故填:Mg(OH)2+2HCl═MgCl2+2H2O;沉淀刚好消失.
(4)溶液D中含有的粒子有水分子、钙离子、钠离子、氯离子,可以表示为:H2O、Ca2+、Na+、Cl-.
故填:H2O、Ca2+、Na+、Cl-.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
18.下列有关实验的评价正确的是( )
| A. | 点燃某可燃物,在火焰上罩一个冷而干燥的烧杯,烧杯的内壁有水雾出现,则可燃物一定是H2或含有H2 | |
| B. | 某混合气体能使灼热的氧化铜变成红色固体,且导出后气体能使澄清石灰水变浑浊,证明原气体中一定含有一氧化碳 | |
| C. | 实验室不用稀硫酸和石灰石制取二氧化碳的原因是,两者无法反应 | |
| D. | 实验室用大理石与盐酸反应制取的CO2通入澄清石灰水无沉淀生成可能是因为盐酸太浓 |
20.拉瓦锡用定量的方法研究空气成分时用到的反应物是( )
| A. | 红磷 | B. | 白磷 | C. | 铜 | D. | 汞 |
 亚硝酸钠(NaNO2)外形与食盐相似,人若误食会引起中毒.NaNO2、NaCl的溶解度曲线如图所示.
亚硝酸钠(NaNO2)外形与食盐相似,人若误食会引起中毒.NaNO2、NaCl的溶解度曲线如图所示.
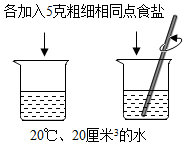 在做配制食盐溶液的实验时,小张总想把食盐溶解的快些,因此他拿起玻璃棒将烧杯中的食盐颗粒捣碎以加快食盐溶解.小张同学的这种操作是否可取?答:可取;
在做配制食盐溶液的实验时,小张总想把食盐溶解的快些,因此他拿起玻璃棒将烧杯中的食盐颗粒捣碎以加快食盐溶解.小张同学的这种操作是否可取?答:可取;