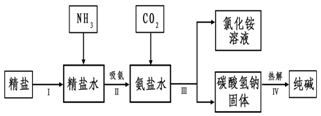
题目内容
16.为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究: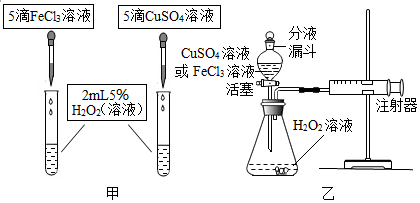
(1)请写出H2O2溶液用FeCl3作催化剂分解的化学方程式2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
(2)如图甲,可通过观察产生气体的快慢来定性比较两者的催化效果,该实验控制的变量有过氧化氢溶液的浓度和用量、滴加催化剂的量.
(3)如图乙,实验前检查该装置气密性的方法是将分液漏斗开关关闭,把导管一端插入水中,然后用手双手捂住锥形瓶外壁,观察导管口是否是气泡冒出,如有,则证明装置气密性良好.要定量比较两者的催化效果,可测量生成等体积气体所需的时间.
(4)在FeCl3溶液中,究竟是哪种粒子起催化作用呢?
猜想1:铁离子起催化作用;猜想2:水分子起催化作用;猜想3:氯离子起催化作用.
小明同学认为可以排除猜想2,他这样认为的原因是过氧化氢溶液中有水存在.
分析 (1)根据反应的原理及化学方程式的书写方法来分析;
(2)根据产生气体的速率及对比实验中的变量和因素来分析;
(3)根据装置气密性检验及比较催化效果的方法来分析;
(4)根据氯化铁溶液中存在铁离子、氯离子和水分子来分析;
解答 解:(1)过氧化氢在氯化铁溶液的催化作用下分解为水和氧气,故填:2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑;
(2)用图甲装置进行实验,应观察同时滴入两种溶液后产生气泡的快慢来判断催化效果;该实验控制的变量有过氧化氢溶液的浓度和用量、滴加催化剂的量,故填:产生气体的快慢;过氧化氢溶液的浓度和用量、滴加催化剂的量;
(3)检查该装置气密性的方法是:将分液漏斗开关关闭,把导管一端插入水中,然后用手双手捂住锥形瓶外壁,观察导管口是否是气泡冒出,如有,则证明装置气密性良好;催化剂的催化效果越好,反应产生气体的速率越快,可通过测量产生等体积的氧气所需要的时间来分析,所需时间越短,催化效果越好;故填:将分液漏斗开关关闭,把导管一端插入水中,然后用手双手捧住锥形瓶外壁,观察导管口是否是气泡冒出,如有,则证明装置气密性良好;时间;
(4)氯化铁溶液中存在铁离子、氯离子和水分子,故猜想可能是铁离子或氯离子或水分子所起的催化作用;可判断不是水分子起催化作用的原因是:过氧化氢溶液中本身含有水分子,如果是水分子的话,就什么也不用添加了.
故填:氯离子;过氧化氢溶液中有水存在;
点评 本题考查实验装置的综合应用,为高频考点,把握反应速率测定原理及影响反应速率的因素为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5. 如图所示,土壤的pH和植物吸收营养元素的关系,阴影纵向宽度越大,表示植物对营养元素的吸收率越高,依据此图,下列说法正确的是( )
如图所示,土壤的pH和植物吸收营养元素的关系,阴影纵向宽度越大,表示植物对营养元素的吸收率越高,依据此图,下列说法正确的是( )
 如图所示,土壤的pH和植物吸收营养元素的关系,阴影纵向宽度越大,表示植物对营养元素的吸收率越高,依据此图,下列说法正确的是( )
如图所示,土壤的pH和植物吸收营养元素的关系,阴影纵向宽度越大,表示植物对营养元素的吸收率越高,依据此图,下列说法正确的是( )| A. | 土壤酸性越强,植物对营养元素吸收率越高 | |
| B. | 植物同时吸收三种营养元素的土壤最佳pH范围是5-6 | |
| C. | 土壤碱性越强,植物对磷元素吸收率越高 | |
| D. | 若土壤酸性过强,可用熟石灰中和 |
6.下列实验方案能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验氯化钙溶液中含有稀盐酸 | 取样,加入适量的碳酸钙 |
| B | 区分氢氧化钠溶液和氢氧气化钙溶液 | 取样,加入无色酚酞溶液 |
| C | 区分三种固体:NH4NO3、NaOH和KNO3 | 取样,加适量水 |
| D | 证明氢氧化钠已部分变质 | 取样,加入少量的稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
1.通常所说的燃烧、爆炸和缓慢氧化之间的相同之处是( )
| A. | 都属于氧化反应 | B. | 都有发光、发热现象 | ||
| C. | 都是剧烈的化学反应 | D. | 可燃物都要达到着火点 |
8.保持水的化学性质的粒子是( )
| A. | 水分子 | B. | 氢分子 | C. | 氧分子 | D. | 氢原子和氧原子 |
5.足量的碳与16g氧气于密闭容器中高温下充分反应,所得气体质量最多为( )
| A. | 20g | B. | 22g | C. | 28g | D. | 44g |