题目内容
6.我县某中学化学实验小组在探究酸的性质时,做了如下实验:(1)分别向A试管(装有碳酸钠粉末),B试管(装有碳酸钙粉末)中注入一定量的稀盐酸,两支试管内均观察到的现象是产生气泡,A、B两支试管固体粉末全部消失,最终变成无色溶液,写出A试管中发生反应的化学方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(2)实验结束后,小组同学将A、B两试管中的废液倒入同一只烧杯中,发现烧杯中的废液变浑浊.写出产生浑浊现象的化学方程式Na2CO3+CaCl2═CaCO3↓+2NaCl.
(3)实验小组的同学将烧杯中的物质进行过滤,对滤液中的溶质的成分展开探究.
【提出猜想】
猜想1:滤液中的溶质是NaCl.
猜想2:滤液中的溶质是NaCl和Na2CO3.
猜想3:滤液中的溶质是NaCl和CaCl2.
【设计实验】请你选择一种猜想进行验证.
| 实验步骤 | 预计实验现象 | 预计结论 |
| 取少量的溶液与试管中, 滴加稀盐酸和碳酸钠溶液,滴加稀盐酸,或滴加碳酸钠溶液 | 无明显现象,或产生气泡,或产生白色沉淀 | 猜想1,或2,或3正确 |
分析 (1)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
(2)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
(3)猜想1:如果碳酸钠和氯化钙恰好完全反应,滤液中的溶质是NaCl.
猜想2:如果碳酸钠过量,滤液中的溶质是NaCl和Na2CO3.
猜想3:如果氯化钙过量,滤液中的溶质是NaCl和CaCl2.
解答 解:(1)分别向A试管(装有碳酸钠粉末),B试管(装有碳酸钙粉末)中注入一定量的稀盐酸,两支试管内均观察到的现象是产生气泡;
A试管中碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,发生反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
故填:产生气泡;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(2)实验结束后,小组同学将A、B两试管中的废液倒入同一只烧杯中,发现烧杯中的废液变浑浊,说明过量的碳酸钠和反应生成的氯化钙反应生成了碳酸钙沉淀和氯化钠,反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl.
故填:Na2CO3+CaCl2═CaCO3↓+2NaCl.
(3)【提出猜想】
猜想1:滤液中的溶质是NaCl.
猜想2:滤液中的溶质是NaCl和Na2CO3.
猜想3:滤液中的溶质是NaCl和CaCl2.
故填:NaCl和CaCl2.
【设计实验】
向试管中滴加稀盐酸、碳酸钠溶液时,无明显现象,说明溶质是氯化钠;
向试管中滴加稀盐酸时,产生气泡,说明溶质是氯化钠和碳酸钠;
向试管中滴加碳酸钠溶液时,产生白色沉淀,说明溶质是氯化钠和氯化钙,实验过程如下表所示:
| 实验步骤 | 预计实验现象 | 预计结论 |
| 取少量的溶液于试管中,滴加稀盐酸和碳酸钠溶液,滴加稀盐酸,或滴加碳酸钠溶液 | 无明显现象,或产生气泡,或产生白色沉淀 | 猜想1,或2,或3正确 |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 暖贴的发热材料主要由铁粉、活性炭、食盐、水等物质构成.
暖贴的发热材料主要由铁粉、活性炭、食盐、水等物质构成.【提出问题】
发热材料中各主要物质起到了什么作用?
【猜想与假设】
Ⅰ.铁粉生锈,发生氧化反应,放出热量.
Ⅱ.活性炭能加快铁粉氧化的速率.
Ⅲ.食盐能加快铁粉氧化的速率.
【进行实验】
| 实验编号 | 实验药品及用量 | 反应时间 /min | 温度上升值/°C | ||||
| 铁粉/g | 活性炭/g | 食盐/g | 水/g | ||||
| 对照组 | 1 | 0.2 | 0.1 | 5 | 10 | 58 | |
| 实 验 组 | 1 | 0 | 0.2 | 0.1 | 5 | 10 | 0 |
| 2 | 1 | 0 | 0.1 | 5 | 10 | 2.7 | |
| 3 | 1 | 0.2 | 0.1 | 0 | 10 | 4.5 | |
| 4 | 10 | 20 | |||||
(1)铁生锈的条件是与水和氧气并存.
(2)已知铁粉在一定条件下生锈,发生氧化反应的产物可能是Fe(OH)3,该反应的化学方程式为4Fe+6H2O+3O2=4Fe(OH)3.
(3)分析2(填实验编号)数据,可证明猜想与假设Ⅱ正确.
(4)分析实验组4与对照组数据,可证明猜想与假设Ⅲ正确.请填写表中空缺数据.
【反思与评价】
(5)某同学认为没有必要进行实验组1,你是否同意他的观点并说明理由不同意,实验1的目的是想证明没有铁,活性炭和食盐与水混合不会放热.
(6)某同学质疑此实验中忽略了发热材料中的水.你认为分析3(填实验编号)的数据,可证明水的作用.
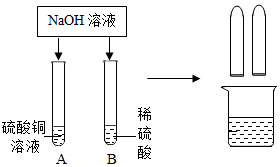 某化学小组在探究碱的化学性质时,做了如图所示的两个实验.
某化学小组在探究碱的化学性质时,做了如图所示的两个实验.(1)写出A试管中发生反应的化学方程式2NaOH+CuSO4═Cu(OH)2↓+Na2SO4.
(2)实验结束后,同学们将A、B两试管中的废液倒入同一洁净的烧杯,烧杯中出现蓝色沉淀.小组同学将烧杯中的物质进行了过滤,对滤液中成分有如下猜想:
【提出猜想】甲:滤液中的溶质是Na2SO4 CuSO4
乙:滤液中的溶质是Na2SO4 H2SO4
丙:滤液中的溶质是NaOH、Na2SO4
丁:滤液中的溶质是Na2SO4
【交流讨论】同学们对以上的猜想提出质疑,认为猜想乙不合理.
【设计实验】同学们通过以下的实验对猜想进行验证,请你完成实验报告.
| 实验内容 | 预计现象 | 预计结论 |
| (1)取少量滤液于试管中,观察 | 溶液呈无色 | 猜想甲不成立 |
| (2)继续在上述试管中加入硫酸铜溶液 | 产生蓝色沉淀 | 猜想丙成立 |
探究目的:探究所得溶液的酸碱性
提出猜想:所得溶液可能呈碱性,也可能呈中性,还可能呈酸性.
实验验证:
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液1~2ml,滴入1~2滴无色酚酞试液,振荡 | 无色酚酞试液变红 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈中性或酸性 |
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是OH-(填写微粒符号).
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到有气泡产生,则所取溶液呈酸性;若无明显现象,则呈中性.
方案二:取样,加入金属锌,若有有气泡产生,则所取溶液呈酸性;若无明显现象,则呈中性.
【提出问题】切开的苹果“生锈”与什么因素有关?
【猜想与假设】
猜想①:可能与空气没有关系,只是果肉内的物质自身相互反应而“生锈”.
猜想②:可能是果肉中的物质与空气中的氧气作用而“生锈”;
猜想③:可能是果肉中的物质与空气中的氮气作用而“生锈”;
猜想④:可能是果肉中的物质与空气中的二氧化碳作用而“生锈”;
猜想⑤:可能是果肉中的物质与空气中的氧气作用而“生锈”,并且苹果“生锈”的速度还可能与温度有关.
【收集证据】
(一)查阅有关资料:已知苹果“生锈”是果肉里的物质(酚和酶)与空气中的一种物质发生反应,生成咖啡色的物质.
(二)实验探究:针对上面的猜想①至猜想⑤,化学活动小组依次设计了实验方案,进行了实验验证,并依次观察到下列实验现象.请你将他们设计的可行的实验探究方案,填写在下表中.
| 猜想 | 可行的实验方案 | 观察到的实验现象 |
| 猜想① | 将一小块果肉浸入盛有蒸馏水的烧杯中,观察现象. | 果肉表面不变色. |
| 猜想② | 将一小块果肉放入盛有氧气的集气瓶中,观察现象. | 果肉表面变色. |
| 猜想③ | 将一小块果肉放入盛有氮气的集气瓶中,观察现象. | 果肉表面不变色. |
| 猜想④ | 将一小块果肉放入盛有二氧化碳的集气瓶中,观察现象. | 果肉表面不变色. |
| 猜想⑤ | 将两块一样的果肉分别放入盛有氧气的集气瓶中,将其中的一个集气瓶放入热水中,观察现象 | 温度高的先变色. |
【反思与评价】(1)在②-⑤四种猜想中,你认为猜想③(填代号)最不合理,理由是氮气化学性质很稳定,通常不与其它物质反应.
(2)在验证猜想①时,同学们发现,如果水不与空气隔绝,果肉放在水中时间长了也会变色,其可能的原因是水中溶解了氧气.
【应用】根据上述结论,要防止果汁变质,果品加工厂加工和保存果汁时可采取的措施是将水果在隔绝空气的条件下加工,采用真空包装并低温保存.
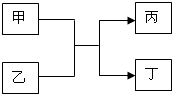 甲、乙、丙、丁是初中化学的常见物质,它们有如图的转化关系:
甲、乙、丙、丁是初中化学的常见物质,它们有如图的转化关系: .
.