题目内容
7.小明同学对部分化学知识归纳如下,其中完全正确的一组是( )| A.物质的分类 | B.化学家及其杰出贡献 |
| ①氧化物中均含有氧元素 ②混合物中一定含有多种元素 ③合成橡胶、合金都属于合成材料 | ①张青莲----测量相对原子质量 ②拉瓦锡----最早发现氧气 ③侯德榜----发明联合制碱法 |
| C.能量变化 | D.用“化学”眼光分析 |
| ①电解水是将电能转化成化学能 ②煤燃烧是将化学能转化成热能 ③在化学反应中只有燃烧才能放出热量 | ①洗涤剂去油污-是乳化作用 ②湿衣服晾干是因为分子在不停的运动 ③明矾净水是因为明矾溶于水生成胶状物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据氧化物、混合物、合成材料的概念、分类进行分析判断.
B、根据化学家以及其贡献分析判断.
C、根据化学变化中能量的变化进行分析判断.
D、根据洗涤剂去油污原理、分子的性质及应用、明矾净水的原理判断.
解答 解:A、氧化物是只含有两种元素且其中一种元素是氧元素的化合物,氧化物中均含有氧元素;混合物中不一定含有多种元素,如氧气和臭氧组成的混合物中,只含有氧元素一种元素;合金属于金属材料;故选项化学知识归纳有错误.
B、拉瓦锡测定空气的组成,不是最早发现空气,故选项化学知识归纳有错误.
C、电解水是将电能转化成化学能;煤燃烧是将化学能转化成光能和热能;在化学反应中不只有燃烧才能放出热量,例如氧化钙和水反应也放热;故选项化学知识归纳有错误;
D、洗涤剂去油污是乳化作用;湿衣服晾干是因为分子在不停的运动;明矾净水是因为明矾溶于水生成胶状物;故选项化学知识归纳完全正确.
故选D.
点评 本题是一道多点知识考查题,解题的关键是掌握物质的性质以及用途知识,属基础性知识考查题.

练习册系列答案
相关题目
17.下列过程中主要涉及物理变化的是( )
| A. | 浓硫酸使白纸变黑 | B. | 用浓硫酸来干燥潮湿的氧气 | ||
| C. | 生石灰遇水变成熟石灰 | D. | 盐酸使紫色石蕊溶液变红色 |
18.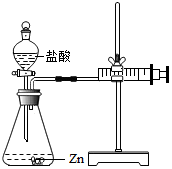 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是其他条件相同时,盐酸浓度越大,反应越剧烈.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响固体的表面积(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为8(b-a)g.
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响固体的表面积(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为8(b-a)g.
12.下列对生活中的现象的解释错误的是( )
| 序号 | 现 象 | 解 释 |
| A | 湿衣服在夏天比冬天干得快 | 温度升高,分子运动速率加快 |
| B | 6000L氧气在加压下可装入容积为40L的钢瓶中 | 分子间间隙大,易于压缩 |
| C | 自行车轮胎在阳光下暴晒而炸裂 | 分子受热,体积变大 |
| D | 成熟的苹果会发出浓浓的香气 | 分子在不断运动 |
| A. | A | B. | B | C. | C | D. | D |
16.下列过程中,发生了化学变化的是( )
| A. | 硝酸钾溶于水 | B. | 从石油中分馏出汽油、煤油等产品 | ||
| C. | 用活性炭吸附冰箱里的异味 | D. | 食物在人体内缓慢消化 |
17.食用豆腐能使人体获得所需要的多种氨基酸,其中含量最多的是亮氨酸(化学式:C6H13NO2),下列有关亮氨酸的说法中不正确的是( )
| A. | 亮氨酸是一种化合物 | |
| B. | 亮氨酸中碳、氧两种元素的原子个数比为3:1 | |
| C. | 一个亮氨酸分子中含有22个原子 | |
| D. | 亮氨酸的分子中含有一个氧分子 |
