题目内容
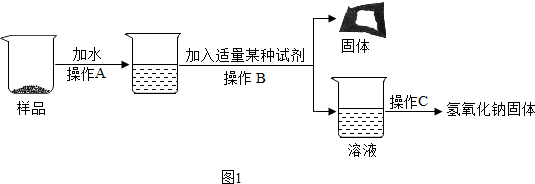
16.在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按如图所示流程进行实验,请你参与讨论并回答相关问题.
(1)贝壳高温锻烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)操作I的名称是过滤;
(3)该流程中没有涉及的基本反应类型是置换反应,;
(4)固体B的化学式为CaCO3;
【问题与发现】该小组同学所得固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH 乙:NaOH和Na2CO3的混合物 丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容.
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量 稀盐酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和的M溶液 | 出现白色沉淀 | 猜想成立 |
②乙、丙同学认为甲同学的实验方案不正确,其理由是碳酸钠溶液和氢氧化钙溶液也呈碱性.
分析 (1)煅烧碳酸钙时,碳酸钙分解能生成氧化钙和二氧化碳;
(2)根据不溶于液体的固体和液体分离的方法考虑解答;
(3)根据题中信息分析解答;
(4)根据碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠解答;
【探究与验证】
显碱性的溶液能使酚酞试液变红色,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钠能和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
①根据碳酸钠能和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠解答;
②碳酸钠、氢氧化钙的水溶液都显碱性,都能够使酚酞试液变红色.
解答 解:
(1)贝壳高温煅烧时,含有的碳酸钙受热分解生成氧化钙和二氧化碳,反应的化学方程式是:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
(2)不溶于液体的固体和液体分离的方法是过滤,过滤用到的玻璃仪器有:烧杯、玻璃棒、漏斗;故填:漏斗;
(3)碳酸钙分解能生成氧化钙和二氧化碳为分解反应,氧化钙和水反应生成氢氧化钙为化合反应,碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠为复分解反应,该流程中没有涉及的基本反应类型是置换反应;
(4)碳酸钠能和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,固体B是碳酸钙,化学式为CaCO3;
【探究与验证】
乙:检验碳酸根离子存在方法:可以加入酸看是否有气体产生,故滴加足量的稀盐酸,如果无气泡产生,说明氢氧化钠中不含有碳酸钠,猜想不成立.故填:稀盐酸;
丙:取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液,如果出现白色沉淀,说明氢氧化钠中含有氢氧化钙,猜想成立.故填:出现白色沉淀.
①丙同学实验中滴加的M溶液可能是碳酸钠溶液,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
②乙、丙同学认为甲同学的实验方案不正确,其理由是碳酸钠溶液和氢氧化钙溶液也呈碱性.
答案:
(1)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
(2)过滤;
(3)置换反应
(4)CaCO3
【探究与验证】
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量 稀盐酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和的M溶液 | 出现白色沉淀 | 猜想成立 |
②碳酸钠溶液和氢氧化钙溶液也呈碱性
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案| A. | 铁 | B. | 干冰 | C. | 氯化钠 | D. | 金刚石 |
| 选项 | 需要鉴别的物质 | 鉴别方法 |
| A | 稀盐酸、氯化钠溶液、氢氧化钠溶液 | 滴加石蕊溶液 |
| B | 硫酸钾、硫酸钡、碳酸钙 | 加入足量的水 |
| C | 氮气、氧气、二氧化碳 | 用燃着的木条区分 |
| D | 铁粉、木炭粉、氧化铜粉末 | 加入足量的稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
【查阅资料】草木灰含有的钾盐主要有碳酸钾、还含有硫酸钾、氯化钾.
(1)草木灰可提供植物必须的营养素是K(填元素符号).
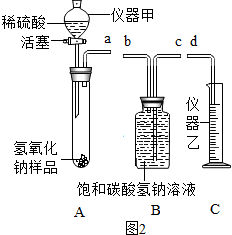
(2)为了确定草木灰含有碳酸钾、硫酸钾和氯化钾,进行以下实验.
(提供的试剂:Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、稀硝酸、稀盐酸、稀硫酸)
步骤1:小明同学取适量草木灰样品于烧杯中,加入过量稀硝酸搅拌,产生大量无色气泡,说明草木灰含有碳酸钾.不选用稀盐酸或稀硫酸的原因是避免引入氯离子和硫酸根离子,从而影响硫酸钾、氯化钾的检验.
请你接着小明同学的实验继续完成下列步骤:
| 实验操作 | 预期实验现象与结论 |
| 步骤2:将步骤1的混合物过滤,取少量滤液于试管中,加入过量的硝酸钡. | 产生了白色, 说明草木灰中含有硫酸钾. |
| 步骤3:将步骤1的混合物过滤,取少量滤液于试管中,加入硝酸银溶液 | 产生了白色沉淀 说明草木灰中含有氯化钾 |
| 物质 | 甲 | 乙 | 丙 | 丁 |  |
| 分子示意图 |  |  |  |  |
| A. | 甲物质属于有机物 | |
| B. | 该反应属于置换反应 | |
| C. | 反应后元素的种类不变 | |
| D. | 该反应的化学方程式为:C2H4+302 $\frac{\underline{\;点燃\;}}{\;}$2C02+2H20 |
| 液体 | 胃液 | 胰液 | 胆汁 | 血浆 |
| pH | 0.9-1.5 | 7.5-8.0 | 7.1-7.3 | 7.35-7.45 |
| A. | 胃液 | B. | 胰液 | C. | 胆汁 | D. | 血浆 |
 图中A、B、C、D是初中化学常见的四种不同类别的无机化合物.A、B、C含有相同的金属元素.图中“━”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系.(部分反应物、生成物及反应条件省略)
图中A、B、C、D是初中化学常见的四种不同类别的无机化合物.A、B、C含有相同的金属元素.图中“━”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系.(部分反应物、生成物及反应条件省略) .
.