题目内容
6. 化学小组同学取一定量碳酸钙固体高温煅烧一段时间,冷却后,对剩余固体成分进行如下探究.
化学小组同学取一定量碳酸钙固体高温煅烧一段时间,冷却后,对剩余固体成分进行如下探究.【查阅资料】工业上通常采用高温煅烧石灰石的方法制生石灰,化学方程式为:
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
该化学小组取80g的固体样品煅烧(杂质质量无变化),煅烧过程中固体质量变化如图所示,求:①碳酸钙中钙元素的质量分数为40%;
②该石灰石样品中碳酸钙的纯度.
【提出问题】煅烧后剩余固体成分是什么?
【猜想与假设】剩余固体成分:
I.全部是氧化钙Ⅱ.氧化钙和碳酸钙Ⅲ.全部是碳酸钙
在老师指导下,小组同学设计如下实验,探究上述猜想是否成立.
【进行实验】
①甲同学取一定量的剩余固体于试管中,加入一定量的水振荡,有白色不溶物.甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅲ成立.乙同学认为上述实验不足以证明猜想Ⅲ成立,其理由是氧化钙与水反应生成的氢氧化钙微溶于水,也可能出现白色不溶物.
②乙同学取一定量的剩余固体于试管中,加入一定量的水,触摸试管外壁感觉发热,继续向试管中加入几滴稀盐酸,没有气泡产生.乙同学据此认为试管中的固体只有氧化钙,即猜想I成立.丙同学认为乙的实验不足以证明猜想I成立,理由是即使有碳酸钙,加入的少量稀盐酸先消耗氢氧化钙,也不会出现气泡.
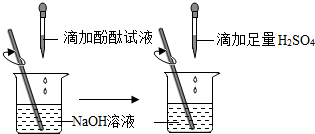
③丙同学利用水、无色酚酞溶液和稀盐酸证明了猜想Ⅱ成立,请完成实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量剩余固体于试管中,加水 振荡,过滤 取滤液滴加无色酚酞溶液 取滤渣滴加足量的稀盐酸 | 溶液变红 有气泡产生 | 猜想Ⅱ成立 |
A.气体肥料 B.制干冰 C.制纯碱 D.制碳酸饮料.
分析 根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析;根据图象结合化学方程式即可求出石灰石中碳酸钙的质量,则可以计算碳酸钙的质量分数;根据物质的性质进行分析,碳酸钙高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,氢氧化钙是微溶于水的物质,其水溶液呈碱性,碳酸钙能与盐酸反应生成二氧化碳气体.
解答 解:【查阅资料】①碳酸钙中钙元素的质量分数为:$\frac{40}{40+12+16×3}$×100%=40%
②由图中信息可知,完全反应后,固体质量减少了:80g-58g=22g,即反应生成了22g二氧化碳,
设碳酸钙的质量为x,
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,
100 44
x 22g
$\frac{100}{x}$=$\frac{44}{22g}$,
x=50g,
该石灰石中CaCO3质量分数为:$\frac{50g}{80g}$×100%=62.5%,
答:石灰石样品中碳酸钙的质量分数是62.5%
【猜想与假设】Ⅱ.部分反应的情况既有氧化钙也有碳酸钙;
①取一定量的剩余固体于试管中,加入一定量的水振荡,有白色不溶物不足以说明只有碳酸钙,因为氧化钙与水反应生成的氢氧化钙微溶于水,也是白色沉淀;
②取一定量的剩余固体于试管中,加入一定量的水,触摸试管外壁感觉发热,继续向试管中加入几滴稀盐酸,没有气泡产生,说明有氧化钙,氧化钙与水反应生成氢氧化钙,不能说明猜想Ⅲ成立,原因是即使有碳酸钙,加入的少量稀盐酸先消耗氢氧化钙,也不会出现气泡;
③利用水、无色酚酞溶液证明氧化钙与水反应生成氢氧化钙,用稀盐酸证明碳酸钙存在;步骤如下:
| 实验步骤 | 实验现象 |
| 取少量剩余固体于试管中,加水 振荡,过滤 取滤液滴加无色酚酞溶液 取滤渣滴加足量的稀盐酸 | 溶液变红 有气泡产生 |
物质的化学性质是指在化学变化中表现出来的性质,做气体肥料、制纯碱、制碳酸饮料都利用了化学性质.
故答案为:【查阅资料】①40%②62.5%;
【猜想与假设】Ⅱ.氧化钙和碳酸钙
【进行实验】
①氧化钙与水反应生成的氢氧化钙微溶于水,也可能出现白色不溶物
②即使有碳酸钙,加入的少量稀盐酸先消耗氢氧化钙,也不会出现气泡
③
| 实验步骤 | 实验现象 |
| 取少量剩余固体于试管中,加水 振荡,过滤 取滤液滴加无色酚酞溶液 取滤渣滴加足量的稀盐酸 | 溶液变红 有气泡产生 |
点评 本题考查了物质变质成分的探究,完成此题,可以依据已有的物质的性质进行.要求同学们熟练掌握常见物质的性质,以便灵活应用.

| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| 加入氯化钾的质量/g | 5 | 10 | 15 | 20 | 25 |
| 溶液的质量/g | 55 | 60 | 65 | 67 | 67 |
| A. | 在20℃时,实验4所得的溶液为饱和溶液 | |
| B. | 在20℃时,所得溶液的溶质的质量分数:实验1<实验2<实验3<实验4<实验5 | |
| C. | 在20℃时,实验1所得的溶液为不饱和溶液,可以通过蒸发溶剂的方法使它变为饱和溶液 | |
| D. | 在20℃时,实验5所得的溶液中溶质的质量为17g |
| A. |  检验CO2 | B. |  用排水法收集O2 | C. |  加热固体 | D. |  测定溶液pH |
| A. | 水烧开后易把壶盖冲起--说明温度升高分子会变大 | |
| B. | 公园的桂花开放时满园飘香--说明分子在不断运动 | |
| C. | 液氧和氧气状态不同,但化学性质相同--它们都由氧分子构成 | |
| D. | 喝了汽水后,常常会打嗝--气体的溶解度随压强的减小而减小 |
| A. | 肯定有Al3+、SO42-,可能有K+、NH4+ | |
| B. | 肯定无Fe2+、Mg2+、CO32-,可能有Al3+ | |
| C. | 原溶液一定是明矾和MgSO4的混合溶液 | |
| D. | 不能确定的离子能通过焰色反应来确定 |
| A. | 水结冰 | B. | 瓷器破碎 | C. | 海水晒盐 | D. | 酒精燃烧 |
| A. | 红磷在空气中燃烧产生大量白烟 | B. | 木炭在氧气中燃烧生成二氧化碳 | ||
| C. | 铁丝在氧气中剧烈燃烧,火星四射 | D. | 镁在空气中燃烧,发出耀眼的白光 |