题目内容
11.一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,是当前使用最为广泛的洗涤助剂之一.某校化学兴趣小组的同学在老师的指导下对该产品开展了以下探究活动.【查阅资料】
“污渍爆炸盐”的主要成分是过碳酸钠(Na2CO4,相对分子质量为122),它是一种白色粉末,易溶于水,且能与水反应,生成一种碳酸盐和一种强氧化性的物质.
【实验探究一】过碳酸钠的性质
为探究过碳酸钠的性质,同学们设计了以下实验,请按要求完成表格内容:
| 序号 | 实验步骤 | 实验现象 | 实验分步结论(或解释) |
| ① | 向盛有过碳酸钠固体的试管中加入适量水 | 固体溶解 | 过碳酸钠易溶于水, 能与水发生反应. |
| ② | 向序号①的所得溶液中加入适量的二氧化锰粉末 | 有大量气泡 产生 | |
| ③ | 将带火星的木条置于试管口 | 木条复燃 | 序号②试管中产生的气体是O2; 过碳酸钠溶于水能生成过氧化氢. |
| ④ | 取序号③试管中的上层清液加入氯化钙溶液 | 产生白色 沉淀 | 反应的化学方程式Na2CO3+CaCl2═CaCO3↓+2NaCl. |
| 小结 | 过碳酸钠与水反应的化学方程式是Na2CO4+H2O═Na2CO3+H2O2. | ||
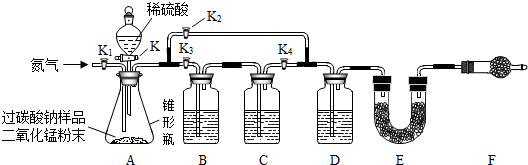
同学们经讨论设计了如图所示的实验装置.图中装置B盛装氢氧化钠溶液,C盛装澄清石灰水,D盛装浓硫酸,E、F均装入干燥的碱石灰(主要成分:氧化钙和氢氧化钠的固体混合物;可吸收二氧化碳和水蒸气).
【实验讨论】
(1)①称量装置E的质量;②组装好装置,检查气密性,装入药品;③关闭活塞K,打开活塞K1,通入氮气;④关闭活塞K、K2,打开活塞K1、K3、K4,通入一段时间的氮气;⑤依次关闭活塞K1、K3、K4,打开活塞K K2、,直到反应不再进行;⑥再次称量装置E的质量.
以上实验步骤的正确顺序是D;
A.①②③④⑤⑥B.②①④⑤③⑥C.①②④⑤③⑥D.②④①⑤③⑥
(2)关闭活塞K、K2,打开活塞K1、K3、K4,通入一段时间的氮气排出装置中原有的空气,此时装置B的作用是除去原有空气中的二氧化碳,防止空气中的二氧化碳进入E装置;
(3)反应完全后关闭活塞K,打开活塞K1,通入氮气的目的是将装置中残留的二氧化碳排出,被E装置充分吸收;
(4)同学们称取6.63g含碳酸钠杂质的过碳酸钠样品(不含其他杂质)进行实验,根据实验后E装置增重2.42g,求该样品中过碳酸钠的含量(写出计算过程,结果保留小数点后一位).
(5)装置F的作用是防止空气中的二氧化碳和水蒸气进入E装置,干扰实验,若不连接装置F,测定的过碳酸钠含量会偏低(填“偏高”或“偏低”).
分析 【实验探究一】①过碳酸钠溶于水时,反应生成碳酸钠和过氧化氢;
③过氧化氢遇二氧化锰能分解生成氧气,所以可以用带火星的木条来检验;
④碳酸钠能和氯化钙反应生成碳酸钙沉淀,根据反应物、生成物和条件书写方程式;
实验小结:根据质量守恒定律和过碳酸钠与水反应的规律书写化学方程式.
【实验探究二】
(1)根据氢氧化钠可以与二氧化碳反应,除去二氧化碳分析;
(2)根据实验要求分析解答;
(3)根据碱石灰的成分和作用分析;
(4)根据碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳;当气体通过浓硫酸时被干燥,通入E中装入碱石灰吸收其中的二氧化碳,利用二氧化碳的质量求出样品中过碳酸钠的含量;
(5)E、F均装入干燥的碱石灰,F装置可以防止空气中的成分进入E装置被吸收.
解答 【实验探究一】①向盛有过碳酸钠固体的试管中加入适量水,目的是让过碳酸钠溶于水且能与水反应;
③根据题给条件可知,过碳酸钠溶于水时,反应生成碳酸钠和过氧化氢,向序号①的所得溶液中加入适量的二氧化锰粉末,产生了大量的气体,可使带火星的木条复燃,说明该气体是氧气,进一步说明了含有过氧化氢溶液;
④碳酸钠和氯化钙反应生成碳酸钙和氯化钠,方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
实验小结:由于过碳酸钠与水反应生成碳酸钠和过氧化氢,说明过碳酸钠中含氧量比碳酸钠高,并且过碳酸钠的相对分子质量为122;碳酸钠的相对分子质量为106,所以过碳酸钠应为Na2CO4;过碳酸钠与水反应的化学方程式为:Na2CO4+H2O=Na2CO3+H2O2;
【实验探究二】
(1)根据实验要求,组装好装置,检查气密性,装入药品,关闭活塞K、K2,打开活塞K1、K3、K4,通入一段时间的氮气;称量装置E的质量,依次关闭活塞K1、K3、K4,打开活塞K2、K;关闭活塞K,打开活塞K1,通入氮气;再次称量装置E的质量.
(2)氢氧化钠可以与二氧化碳反应,除去空气中的二氧化碳,防止空气中的二氧化碳进入E装置;
(3)过碳酸钠溶于水时,反应生成碳酸钠和过氧化氢,过氧化氢在二氧化锰作用下生成水和氧气;碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳;当气体通过浓硫酸时被干燥,通入E中装入碱石灰吸收其中的二氧化碳;实验完毕后通入氮气的目的是将装置中的气体排出,被E装置完全吸收;
(4)Na2CO4+H2O=Na2CO3+H2O2,Na2CO3+2HCl═2NaCl+H2O+CO2↑,
122 106 106 44
x $\frac{106x}{122}$ $\frac{106x}{122}$+6.63g-x 2.42g
$\frac{106}{\frac{106x}{122}+6.63g-x}=\frac{44}{2.42g}$
x=6.1g,
该样品中过碳酸钠的含量为:$\frac{6.1g}{6.63g}$×100%=92.0%,
(5)F装入干燥的碱石灰,F装置可以防止空气中的二氧化碳和水蒸气进入E装置被吸收,这样E装置在测定前后的质量差值偏大,计算出了样品中碳酸钠的含量偏高,过碳酸钠的含量偏低.
答案:
| 序号 | 实验步骤 | 实验现象 | 实验分步结论(或解释) |
| ① | 向盛有过碳酸钠固体的试管中加入适量水 | 固体溶解 | 过碳酸钠易溶于水, 能与水发生反应. |
| ② | 向序号①的所得溶液中加入适量的二氧化锰粉末 | 有大量气泡 产生 | |
| ③ | 将带火星的木条置于试管口 | 木条复燃 | 序号②试管中产生的气体是 O2; 过碳酸钠溶于水能生成过氧化氢. |
| ④ | 取序号③试管中的上层清液加入氯化钙溶液 | 产生白色 沉淀 | 反应的化学方程式 Na2CO3+CaCl2═CaCO3↓+2NaCl. |
| 小结 | 过碳酸钠与水反应的化学方程式是 Na2CO4+H2O═Na2CO3+H2O2. | ||
(2)除去原有空气中的二氧化碳,防止空气中的二氧化碳进入E装置
(3)将装置中残留的二氧化碳排出,被E装置充分吸收
(4)该样品中过碳酸钠的含量为92%
(5)防止空气中的二氧化碳和水蒸气进入E装置,干扰实验;偏低
点评 本题主要考查同学们的实验分析能力,难度较大,记住氧气的检验方法,掌握过氧化氢和碳酸钠的性质,能够根据物质的性质来选择合适的方法来对物质加以验证,其中检验碳酸盐常用的方法是用稀盐酸和氯化钙等.

 名校课堂系列答案
名校课堂系列答案 某课外活动小组的同学在整理化学药品柜时,发现一瓶标签受损的无色液体,如图所示.老师告诉大家,该瓶液体是下列5种液体中的某一种:
某课外活动小组的同学在整理化学药品柜时,发现一瓶标签受损的无色液体,如图所示.老师告诉大家,该瓶液体是下列5种液体中的某一种:稀H2SO4、H2O、NaNO3溶液、NaOH溶液、CuSO4溶液.
(1)根据以上信息判断,该无色液体一定不是CuSO4溶液和H2O.
(2)为确定该液体的成分,同学们设计了下列实验方案,请你一起探究.
| 实验操作 | 实验现象 | 实验结论 |
| ①取该液体适量于试管中,向其中滴加无色酚酞溶液 | 溶液颜色无变化 | 该液体不是NaOH溶液 |
| ②另取该液体适量于试管中,向其中加入锌粒 | 有气泡产生 | 该液体是稀H2SO4,不是NaNO3溶液 |
| A. | 拒绝使用一次性木筷,提倡反复使用塑料袋 | |
| B. | 将废纸、汽水瓶等收集起来,进行统一焚烧 | |
| C. | 纸张提倡双面使用,用电子贺卡代替纸制贺卡 | |
| D. | 选择自行车和公交车作为出行工具 |
| A. |  测溶液pH | B. |  过滤 | C. |  称取氯化钠 称取氯化钠 | D. |  稀释浓硫酸 |
| A.性质与用途 | B.保护环境 |
| 利用熟石灰的碱性改良酸性土壤 利用一氧化碳的还原性冶炼金属 利用氧化铝薄膜的致密性防止铝被腐蚀 | 使用无磷洗衣粉可减少水污染 不使用一次性塑料袋可减少白色污染 化石燃料不充分燃烧不会污染空气 |
| C.安全常识 | D.营养物质 |
| 进入地窖要先做灯火实验 面粉加工厂要严禁明火 炒菜时,食用油着火要立即用水浇灭 | 缺钙易患坏血病 蛋白质由多种氨基酸构成 糖类和油脂可以提供能量 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 铁丝在空气中剧烈燃烧,火星四射 | |
| B. | 棉线在空气中燃烧时,产生烧焦羽毛气味的气体 | |
| C. | 打开盛放浓盐酸的试剂瓶盖,瓶口有白烟 | |
| D. | 在氢氧化钠稀溶液中滴加适量硫酸铜溶液,产生蓝色沉淀 |
| 选项 | 物质(括号内杂质) | 试剂 | 操作方法 |
| A | HCl(CO2) | 适量NaOH溶液 | 洗气 |
| B | CO2(CO) | 足量O 2 | 点燃 |
| C | NaCl(NaOH) | 过量稀盐酸 | 蒸发结晶 |
| D | 稀盐酸(稀硫酸) | 适量硝酸钡溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
 镁合金因具有许多优良的性能,广泛应用于航空航天、新能源汽车等领域,被誉为“21世纪绿色工程材料”.
镁合金因具有许多优良的性能,广泛应用于航空航天、新能源汽车等领域,被誉为“21世纪绿色工程材料”.