题目内容
3.下列对实验现象的描述,正确的是( )| A. | 铁丝在空气中剧烈燃烧,火星四射 | |
| B. | 棉线在空气中燃烧时,产生烧焦羽毛气味的气体 | |
| C. | 打开盛放浓盐酸的试剂瓶盖,瓶口有白烟 | |
| D. | 在氢氧化钠稀溶液中滴加适量硫酸铜溶液,产生蓝色沉淀 |
分析 A、根据铁丝在空气中燃烧的现象进行分析判断.
B、根据棉线在空气中燃烧的现象进行分析判断.
C、根据浓盐酸具有挥发性进行分析判断.
D、根据碱的化学性质进行分析判断.
解答 解:A、铁丝在空气中只能烧至发红,不会产生火星,故选项说法错误.
B、棉线在空气中燃烧,有烧纸的气味,不会产生烧焦羽毛气味的气体,故选项说法错误.
C、浓盐酸具有挥发性,打开盛放浓盐酸的试剂瓶盖,瓶口有白雾,而不是白烟,故选项说法错误.
D、氢氧化钠稀溶液与硫酸铜溶液反应生成氢氧化铜蓝色沉淀,在氢氧化钠稀溶液中滴加适量硫酸铜溶液,产生蓝色沉淀,故选项说法正确.
故选:D.
点评 本题难度不大,掌握常见物质燃烧的现象、浓盐酸具有挥发性、碱的化学性质即可正确解答,在描述实验现象时,需要注意烟和雾的区别.

练习册系列答案
相关题目
14.今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”,为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品.分别在5只烧杯中进行了实验,实验数据见下表(假设纸张中其他成分既不溶于水,也不与酸反应):
(1)表中X的值为2.64;
(2)求样品中碳酸钙的质量分数;(完成计算过程,下同)
(3)烧杯④中物质充分反应后所得溶液的质量分数.(计算结果精确到0.1%)
| 烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
| 加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
| 加入稀盐酸的质量/g | 15 | 30 | 45 | 60 | 75 |
| 充分反应后生成气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
(2)求样品中碳酸钙的质量分数;(完成计算过程,下同)
(3)烧杯④中物质充分反应后所得溶液的质量分数.(计算结果精确到0.1%)
11.一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,是当前使用最为广泛的洗涤助剂之一.某校化学兴趣小组的同学在老师的指导下对该产品开展了以下探究活动.
【查阅资料】
“污渍爆炸盐”的主要成分是过碳酸钠(Na2CO4,相对分子质量为122),它是一种白色粉末,易溶于水,且能与水反应,生成一种碳酸盐和一种强氧化性的物质.
【实验探究一】过碳酸钠的性质
为探究过碳酸钠的性质,同学们设计了以下实验,请按要求完成表格内容:
【实验探究二】过碳酸钠的含量测定
同学们经讨论设计了如图所示的实验装置.图中装置B盛装氢氧化钠溶液,C盛装澄清石灰水,D盛装浓硫酸,E、F均装入干燥的碱石灰(主要成分:氧化钙和氢氧化钠的固体混合物;可吸收二氧化碳和水蒸气).
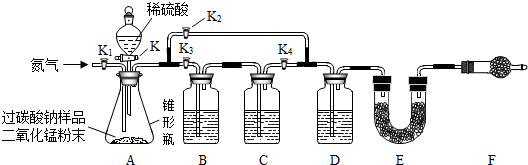
【实验讨论】
(1)①称量装置E的质量;②组装好装置,检查气密性,装入药品;③关闭活塞K,打开活塞K1,通入氮气;④关闭活塞K、K2,打开活塞K1、K3、K4,通入一段时间的氮气;⑤依次关闭活塞K1、K3、K4,打开活塞K K2、,直到反应不再进行;⑥再次称量装置E的质量.
以上实验步骤的正确顺序是D;
A.①②③④⑤⑥B.②①④⑤③⑥C.①②④⑤③⑥D.②④①⑤③⑥
(2)关闭活塞K、K2,打开活塞K1、K3、K4,通入一段时间的氮气排出装置中原有的空气,此时装置B的作用是除去原有空气中的二氧化碳,防止空气中的二氧化碳进入E装置;
(3)反应完全后关闭活塞K,打开活塞K1,通入氮气的目的是将装置中残留的二氧化碳排出,被E装置充分吸收;
(4)同学们称取6.63g含碳酸钠杂质的过碳酸钠样品(不含其他杂质)进行实验,根据实验后E装置增重2.42g,求该样品中过碳酸钠的含量(写出计算过程,结果保留小数点后一位).
(5)装置F的作用是防止空气中的二氧化碳和水蒸气进入E装置,干扰实验,若不连接装置F,测定的过碳酸钠含量会偏低(填“偏高”或“偏低”).
【查阅资料】
“污渍爆炸盐”的主要成分是过碳酸钠(Na2CO4,相对分子质量为122),它是一种白色粉末,易溶于水,且能与水反应,生成一种碳酸盐和一种强氧化性的物质.
【实验探究一】过碳酸钠的性质
为探究过碳酸钠的性质,同学们设计了以下实验,请按要求完成表格内容:
| 序号 | 实验步骤 | 实验现象 | 实验分步结论(或解释) |
| ① | 向盛有过碳酸钠固体的试管中加入适量水 | 固体溶解 | 过碳酸钠易溶于水, 能与水发生反应. |
| ② | 向序号①的所得溶液中加入适量的二氧化锰粉末 | 有大量气泡 产生 | |
| ③ | 将带火星的木条置于试管口 | 木条复燃 | 序号②试管中产生的气体是O2; 过碳酸钠溶于水能生成过氧化氢. |
| ④ | 取序号③试管中的上层清液加入氯化钙溶液 | 产生白色 沉淀 | 反应的化学方程式Na2CO3+CaCl2═CaCO3↓+2NaCl. |
| 小结 | 过碳酸钠与水反应的化学方程式是Na2CO4+H2O═Na2CO3+H2O2. | ||
同学们经讨论设计了如图所示的实验装置.图中装置B盛装氢氧化钠溶液,C盛装澄清石灰水,D盛装浓硫酸,E、F均装入干燥的碱石灰(主要成分:氧化钙和氢氧化钠的固体混合物;可吸收二氧化碳和水蒸气).

【实验讨论】
(1)①称量装置E的质量;②组装好装置,检查气密性,装入药品;③关闭活塞K,打开活塞K1,通入氮气;④关闭活塞K、K2,打开活塞K1、K3、K4,通入一段时间的氮气;⑤依次关闭活塞K1、K3、K4,打开活塞K K2、,直到反应不再进行;⑥再次称量装置E的质量.
以上实验步骤的正确顺序是D;
A.①②③④⑤⑥B.②①④⑤③⑥C.①②④⑤③⑥D.②④①⑤③⑥
(2)关闭活塞K、K2,打开活塞K1、K3、K4,通入一段时间的氮气排出装置中原有的空气,此时装置B的作用是除去原有空气中的二氧化碳,防止空气中的二氧化碳进入E装置;
(3)反应完全后关闭活塞K,打开活塞K1,通入氮气的目的是将装置中残留的二氧化碳排出,被E装置充分吸收;
(4)同学们称取6.63g含碳酸钠杂质的过碳酸钠样品(不含其他杂质)进行实验,根据实验后E装置增重2.42g,求该样品中过碳酸钠的含量(写出计算过程,结果保留小数点后一位).
(5)装置F的作用是防止空气中的二氧化碳和水蒸气进入E装置,干扰实验,若不连接装置F,测定的过碳酸钠含量会偏低(填“偏高”或“偏低”).
18.下列四个图象分别表示对应的四种操作过程,其中表示正确的图象是( )
| A. |  向pH=2的酸溶液中不断加水 | |
| B. |  向NaOH溶液中逐滴加入稀盐酸 | |
| C. |  向一定量的水中持续加入食盐(m表示食盐的质量,A%表示溶质分数) | |
| D. |  等质量的锌、铁与足量的稀硫酸反应,产生氢气的质量随反应时间t的变化 |
15.某班甲、乙两组同学分别做常见酸和碱与指示剂反应的实验,使用的试剂有稀盐酸、稀硫酸、氢氧化钠溶液和酚酞试液.实验后废液分别集中到各组的一个废液缸中.研究小组对两个组的废液进行检测,结果如下表.下列说法正确的是(不考虑酚酞和水)( )
| 废液来源 | 甲组 | 乙组 |
| 检测方法与结果 | 观察废液呈无色 | 观察废液呈红色 |
| A. | 甲组废液中一定含有稀盐酸或稀硫酸 | |
| B. | 乙组废液中一定含有氢氧化钠、氯化钠、硫酸钠 | |
| C. | 甲组废液可直接排放,乙组处理后再排放 | |
| D. | 如将两组的废液合并在一起,如溶液呈无色,混合液可直接排放 |
12.我们每天都生活在不断变化的物质世界里,下列变化一定属于化学变化的是( )
| A. | 用干冰做制冷剂进行人工降雨 | |
| B. | 厨房中用NaOH除油污 | |
| C. | 用沾有酒精的毛巾擦去书桌上的油渍 | |
| D. | 夏天车胎爆胎 |
 为探究燃烧的条件,设计如图甲、乙两个实验.请回答:
为探究燃烧的条件,设计如图甲、乙两个实验.请回答: