题目内容
14.某工厂用电解饱和食盐水方法生产氯气、烧碱、氢气等化工产品,这种工业称为“氯碱工业”. (反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑),某研究性学习小组对该厂生产的烧碱样品进行如下探究.Ⅰ.定性探究
【提出问题】烧碱样品中可能含有哪些杂质?
【猜 想】一:可能含有Na2CO3,作出此猜想的依据是CO2+2NaOH═Na2CO3+H2O (用化学方程式表示).
二:可能含有NaCl,作出此猜想的依据是可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是:氢氧化钠固体.溶于水放热 |
| ②向①所得的溶液中逐滴加入稀硝酸至过量 | 开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是Na2CO3. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀现象 | 样品中还含有的杂质是NaCl. |
不正确(填“正确”或“不正确”).
Ⅱ.定量探究
【提出问题】如何测定烧碱样品中氢氧化钠的质量分数呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
【实验一】取烧碱样品20g,加足量稀盐酸,称量反应前后D装置的质量增重0.22g;
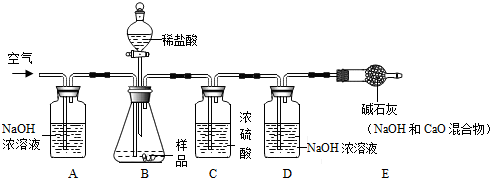
根据实验过程回答下列问题:
(1)装置B中发生反应的化学方程式NaOH+HCl═NaCl+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)实验过程中需持续缓缓通入空气,其作用有:
①搅拌B、C 中的反应物,使其充分反应;②使生成的二氧化碳全部进入D装置;
(3)装置C的作用是除去水蒸气;若没有E装置,则测得样品中杂质的质量分数偏大(填“偏大”、“偏小”或“不变”).
【实验二】取烧碱样品20g加水充分溶解,加足量AgNO3溶液和稀HNO3,过滤、洗涤、干燥,称量生成2.87g白色滤渣.
请你利用小婉同学测得的实验数据.
分析 二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可能有碳酸钠;氯化钠可能没有全部反应,因此可能有氯化钠.加水溶解,试管外壁发热,原因是氢氧化钠固体溶于水放热;向①所得的溶液中逐渐加入稀硝酸至过量,一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的气体,因此样品中含有的杂质是碳酸钠;向②所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有的杂质是氯化钠;上述实验中稀硝酸不可以用稀盐酸代替,因为盐酸中有氯离子,影响氯化钠中氯离子的检验.
解答 解:【猜 想】一:二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可能有碳酸钠,反应的化学方程式为CO2+2NaOH═Na2CO3+H2O;故答案为:CO2+2NaOH═Na2CO3+H2O;
二:氯化钠可能没有全部反应,因此可能有氯化钠;故填:可能有少量的氯化钠没有反应;
【设计实验】
加水溶解,试管外壁发热,原因是氢氧化钠固体溶于水放热;向①所得的溶液中逐渐加入稀硝酸至过量,一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的气体,因此样品中含有的杂质是碳酸钠;向②所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有的杂质是氯化钠;上述实验中稀硝酸不可以用稀盐酸代替,因为盐酸中有氯离子,影响氯化钠中氯离子的检验.
故答案为:氢氧化钠固体溶于水放热;Na2CO3;白色沉淀;不正确;
Ⅱ.定量探究(1)盐酸和氢氧化钠反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式分别为NaOH+HCl═NaCl+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑;故填:NaOH+HCl═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)实验过程中需持续缓缓通入空气,其作用有:①搅拌B、C 中的反应物,使其充分反应;②使生成的二氧化碳全部进入D装置;故填:使生成的二氧化碳全部进入D装置;
(3)浓硫酸具有吸水性,所以装置C的作用是除去水蒸气;若没有E装置,则空气中的二氧化碳会进入D装置,使测得样品中杂质的质量分数偏大;故填:除去水蒸气;偏大;
【实验二】设20g样品中含有碳酸钠的质量为x,氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 0.22g
$\frac{106}{x}=\frac{44}{0.22g}$
x=0.53g
NaCl+AgNO3═AgCl↓+NaNO3
58.5 143.5
y 2.87g
$\frac{58.5}{y}=\frac{143.5}{2.87g}$
y=1.17g
氢氧化钠的质量分数=$\frac{20g-0.53g-1.17g}{20g}$×100%=91.5%
答:氢氧化钠的质量分数是91.5%.
点评 本考点属于实验探究题,既有物质性质的检验,又有化学方程式的书写和有关的计算,综合性比较强.本题根据题目提供的信息,结合实验探究的一般步骤和碱的性质等知识来解决,还要注意化学方程式的书写和配平,有关的计算要准确.本考点主要出现在实验题中.

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式:H2SO4+2NaOH═Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH 猜想四:有Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是三,理由是稀硫酸和氢氧化钠不能共存.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有氢氧化钠.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、AgNO3溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 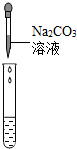 | 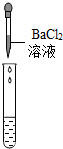 |
| 实验现象 | 试纸变色,对比比色卡,pH=1 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是把pH试纸浸入溶液中.
(2)实验方案中也有一个错误的,错误的原因是硫酸钠也能够和氯化钡反应生成硫酸钡沉淀.
| A. |  榨取果汁 | B. |  粉碎废纸 | C. |  沙里淘金 | D. |  燃放烟花 |
| A. | 细铁丝在氧气中燃烧时集气瓶底炸裂--集气瓶底部未放入少量水或细沙 | |
| B. | 加热碱式碳酸铜粉末时试管破裂--试管口未向上倾斜 | |
| C. | 用pH试纸测定稀盐酸的pH值偏大一pH试纸预先用水润湿 | |
| D. | 加热高锰酸钾制氧气时水倒吸入试管--先熄灭酒精灯后撤导管 |
| A. |  闻气体气味 | B. |  制备和检验氢气的可燃性 | ||
| C. |  稀释浓硫酸 | D. |  测溶液pH |
| A. | 滤渣中一定有镁粉 | B. | 滤渣中一定有铜和银 | ||
| C. | 滤液中一定有Mg2+ | D. | 滤液中一定有Ag+和Cu2+ |
