题目内容
5.为了制取C02气体并验证其性质,小林同学设计并进行了图1所示的实验,请根据要求回答有关问题.
(1)仪器①的名称为长颈漏斗,实验室制取并收集少量二氧化碳气体应选用的装置组合是BD(填装置字母代号).
(2)若用图1中的装置E、F、G验证二氧化碳的性质,当通入二氧化碳一段时间后,F中的现象是紫色石蕊试液变成红色,G中观察到下面的蜡烛先熄灭,上面的蜡烛后熄灭,说明二氧化碳具有的化学性质是二氧化碳密度比空气大,不能燃烧,也不能支持燃烧.
(3)小波同学是位善于动脑筋的学生,他将装置B进行了改进(如图2中I和Ⅱ).
装置I的主要优点是随开随用,随关随停,装置Ⅱ的主要优点是控制反应速率.
用装置I制取二氧化碳时,若将其中的铜网换成铁网,产生的后果是制取的二氧化碳气体不纯.
分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用,实验室制取二氧化碳的反应物是固体和液体,反应条件是常温进行分析;
(2)根据二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊变红色,以及G中观察到下面的蜡烛先熄灭,上面的蜡烛后熄灭的现象进行分析;
(3)根据装置内通过气压差,可以实现固体和液体分离,注射器可以控制液体的滴加速度,铁丝会与盐酸反应生成氯化亚铁和氢气进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,①是长颈漏斗,实验室制取二氧化碳的反应物是固体和液体,反应条件是常温,使用实验室制取并收集少量二氧化碳气体应选用的装置组合是BD;
(2)二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊变红色,所以当通入二氧化碳一段时间后,F中的现象是:紫色石蕊试液变成红色,G中观察到下面的蜡烛先熄灭,上面的蜡烛后熄灭的现象,说明二氧化碳具有的化学性质是:二氧化碳密度比空气大,不能燃烧,也不能支持燃烧;
(3)装置内通过气压差,可以实现固体和液体分离,所以装置I的主要优点是:随开随用,随关随停,注射器可以控制液体的滴加速度,所以装置Ⅱ的主要优点是:控制反应速率,铁丝会与盐酸反应生成氯化亚铁和氢气,所以用装置I制取二氧化碳时,若将其中的铜网换成铁网,产生的后果是制取的二氧化碳气体不纯.
故答案为:(1)长颈漏斗,BD;
(2)紫色石蕊试液变成红色,二氧化碳密度比空气大,不能燃烧,也不能支持燃烧;
(3)随开随用,随关随停;
控制反应速率;
制取的二氧化碳气体不纯.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.安徽是农业大省,水稻是安徽省的主要粮食作物之一.下列有关水稻种植过程及其相关应用的叙述中涉及到化学变化的是( )
| A. |  栽种秧苗 | B. |  收割水稻 | C. |  稻谷晾晒 | D. |  稻草发电 |
10.化学式一门以实验为基础的科学,正确的实验操作是完成实验认为的保证.下列做法中,不合理的是( )
| A. | 测定空气中氧气的含量时,可以使用白磷 | |
| B. | 做铁丝在氧气中燃烧实验时,预先在集气瓶中加少量水 | |
| C. | 稀释浓硫酸时,将浓硫酸注入盛水的量筒中 | |
| D. | 给烧杯中的液体加热时应使用石棉网 |
17.铝合金、氧化铝、硫酸铝三种物质的分类正确的是( )
| A. | 混合物、氧化物、盐 | B. | 混合物、盐、化合物 | ||
| C. | 单质、混合物、盐 | D. | 金属单质、氧化物、纯净物 |
14.某工厂用电解饱和食盐水方法生产氯气、烧碱、氢气等化工产品,这种工业称为“氯碱工业”. (反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑),某研究性学习小组对该厂生产的烧碱样品进行如下探究.
Ⅰ.定性探究
【提出问题】烧碱样品中可能含有哪些杂质?
【猜 想】一:可能含有Na2CO3,作出此猜想的依据是CO2+2NaOH═Na2CO3+H2O (用化学方程式表示).
二:可能含有NaCl,作出此猜想的依据是可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
【交流与讨论 小明同学提出:“上述实验中稀硝酸也可以用稀盐酸代替”.你认为他的观点
不正确(填“正确”或“不正确”).
Ⅱ.定量探究
【提出问题】如何测定烧碱样品中氢氧化钠的质量分数呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
【实验一】取烧碱样品20g,加足量稀盐酸,称量反应前后D装置的质量增重0.22g;
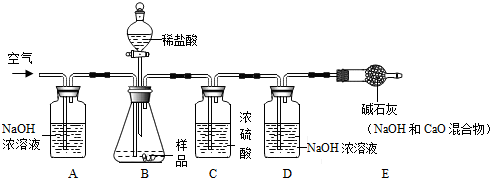
根据实验过程回答下列问题:
(1)装置B中发生反应的化学方程式NaOH+HCl═NaCl+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)实验过程中需持续缓缓通入空气,其作用有:
①搅拌B、C 中的反应物,使其充分反应;②使生成的二氧化碳全部进入D装置;
(3)装置C的作用是除去水蒸气;若没有E装置,则测得样品中杂质的质量分数偏大(填“偏大”、“偏小”或“不变”).
【实验二】取烧碱样品20g加水充分溶解,加足量AgNO3溶液和稀HNO3,过滤、洗涤、干燥,称量生成2.87g白色滤渣.
请你利用小婉同学测得的实验数据.
Ⅰ.定性探究
【提出问题】烧碱样品中可能含有哪些杂质?
【猜 想】一:可能含有Na2CO3,作出此猜想的依据是CO2+2NaOH═Na2CO3+H2O (用化学方程式表示).
二:可能含有NaCl,作出此猜想的依据是可能有少量的氯化钠没有反应(用简洁的文字表述).
【设计实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是:氢氧化钠固体.溶于水放热 |
| ②向①所得的溶液中逐滴加入稀硝酸至过量 | 开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是Na2CO3. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀现象 | 样品中还含有的杂质是NaCl. |
不正确(填“正确”或“不正确”).
Ⅱ.定量探究
【提出问题】如何测定烧碱样品中氢氧化钠的质量分数呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
【实验一】取烧碱样品20g,加足量稀盐酸,称量反应前后D装置的质量增重0.22g;

根据实验过程回答下列问题:
(1)装置B中发生反应的化学方程式NaOH+HCl═NaCl+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)实验过程中需持续缓缓通入空气,其作用有:
①搅拌B、C 中的反应物,使其充分反应;②使生成的二氧化碳全部进入D装置;
(3)装置C的作用是除去水蒸气;若没有E装置,则测得样品中杂质的质量分数偏大(填“偏大”、“偏小”或“不变”).
【实验二】取烧碱样品20g加水充分溶解,加足量AgNO3溶液和稀HNO3,过滤、洗涤、干燥,称量生成2.87g白色滤渣.
请你利用小婉同学测得的实验数据.
15.要将粗盐提纯,并用制得的精盐配制50g质量分数为8%的氯化钠溶液,下列说法正确的是( )
| A. | 蒸发滤液时,待蒸发皿中滤液蒸干后停止加热 | |
| B. | 粗盐溶解和过滤操作时,都用到了玻璃棒,玻璃棒的作用相同 | |
| C. | 配制该溶液需要氯化钠8g,水42g | |
| D. | 配制溶液需要经过计算、称量、量取、溶解、装瓶、贴标签等步骤 |
 甲、乙、丙三种固体物质在水中的溶解度曲线如图所示.
甲、乙、丙三种固体物质在水中的溶解度曲线如图所示. A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:
A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题: