题目内容
 水是重要的自然资源,是人类赖以生存的物质基础.
水是重要的自然资源,是人类赖以生存的物质基础.(1)水是很好的溶剂,下列物质与水混合不能形成溶液的是
A.蔗糖 B.食盐 C.植物油 D.酒精
(2)水溶液的应用非常广泛.3%的过氧化氢溶液可用于消毒,配制3%的过氧化氢溶液500g,需要30% 的过氧化氢溶液
(3)天然水是混合物,用如图1所示的简易装置净化水时,活性炭的主要作用是
(4)英国科学家日前研制出一种名叫“干水”的物质(如图2),每个“干水”粒子是由小水滴、外层包上沙质硅膜组成的.这种糖粉状物质的最大特色是具有强力吸收二氧化碳的能力,具有极高的商业价值.下列有关“干水”的叙述正确的是
A.“干水”属于纯净物 B.“干水”的化学式为H2O
C.“干水”可用于降低温室效应 D.“干水”是一种糖类物质.
考点:溶液的概念、组成及其特点,硬水与软水,有关溶质质量分数的简单计算,纯净物和混合物的判别,碳单质的物理性质及用途,质量守恒定律及其应用
专题:溶液、浊液与溶解度,空气与水
分析:(1)蔗糖、食盐、酒精都能溶于水,从而形成溶液,而植物油不能溶于水,与水混合形成乳浊液;
(2)根据一定质量分数的溶液的配制方法进行分析;
(3)根据活性炭的特性,软硬水的区别方法及醋酸和碳酸钙的反应进行分析;
(4)根据“干水”的组成成份进行分析;
(2)根据一定质量分数的溶液的配制方法进行分析;
(3)根据活性炭的特性,软硬水的区别方法及醋酸和碳酸钙的反应进行分析;
(4)根据“干水”的组成成份进行分析;
解答:解:(1)蔗糖、食盐、酒精都能溶于水,从而形成溶液,而植物油不能溶于水,与水混合形成乳浊液;故选C;
(2)配制3%的过氧化氢溶液500g,需要溶质500g×3%=15g,则需要30% 的过氧化氢溶液质量为:15g÷30%=50g,故答案为:50g;
(3)水净化时用活性炭是利用了它的吸附性,把水的色素及杂质吸附掉;区别硬水和软水的方法是加入肥皂水,泡沫丰富的是软水,泡沫少有絮状沉淀产生的是硬水;水垢的主要成分为碳酸钙和氢氧化镁.食醋与碳酸钙的反应方程式是:CaCO3+2CH3COOH═(CH3COO)2Ca+CO2↑+H2O;
(4)从“干水”的成份来看,它是混合物,从它的作用来分析,它具有强力吸收二氧化碳的能力,因此可用于降低温室效应,故选C;
故答案为:(1)C;(2)50;(3)吸附; 取样,滴加肥皂水,若有絮状沉淀产生是硬水;CaCO3+2CH3COOH═(CH3COO)2Ca+CO2↑+H2O; (4)C.
(2)配制3%的过氧化氢溶液500g,需要溶质500g×3%=15g,则需要30% 的过氧化氢溶液质量为:15g÷30%=50g,故答案为:50g;
(3)水净化时用活性炭是利用了它的吸附性,把水的色素及杂质吸附掉;区别硬水和软水的方法是加入肥皂水,泡沫丰富的是软水,泡沫少有絮状沉淀产生的是硬水;水垢的主要成分为碳酸钙和氢氧化镁.食醋与碳酸钙的反应方程式是:CaCO3+2CH3COOH═(CH3COO)2Ca+CO2↑+H2O;
(4)从“干水”的成份来看,它是混合物,从它的作用来分析,它具有强力吸收二氧化碳的能力,因此可用于降低温室效应,故选C;
故答案为:(1)C;(2)50;(3)吸附; 取样,滴加肥皂水,若有絮状沉淀产生是硬水;CaCO3+2CH3COOH═(CH3COO)2Ca+CO2↑+H2O; (4)C.
点评:本题考查溶液的概念及有关溶液的计算,水的净化,软硬水的区别,去除水垢的方法,“干水”的作用等知识,考查范围较广,要让学生平时多积累.

练习册系列答案
相关题目
日常生活中的下列变化,属于化学变化的是( )
A、 湿衣服晾干 |
B、 燃烧鞭炮 |
C、 朝玻璃片吹起 |
D、 玻璃镜破碎 |
 a、b、c三种固体物质的溶解度曲线如图所示.下列说法正确的是( )
a、b、c三种固体物质的溶解度曲线如图所示.下列说法正确的是( )| A、t1℃时,a、b、c三种物质的溶解度由大到小的顺序是b>a>c |
| B、t2℃时,30 g a物质加入到50 g水中不断搅拌,所得溶液溶质质量分数为37.5% |
| C、将t1℃时c的饱和溶液升温到t2℃,变为不饱和溶液 |
| D、t2℃时,将相同质量的a、b、c三种物质的饱和溶液降温到t1℃,析出晶体最多的是a |
 甲、乙、丙、丁、X是水、二氧化碳、盐酸、氢氧化钠、氢氧化钙、碳酸钠、碳酸钙中的一种,常温下它们的转化关系如图所示(部分反应的生成物未全部标出),下列推断正确的是( )
甲、乙、丙、丁、X是水、二氧化碳、盐酸、氢氧化钠、氢氧化钙、碳酸钠、碳酸钙中的一种,常温下它们的转化关系如图所示(部分反应的生成物未全部标出),下列推断正确的是( )| A、若X是氢氧化钠,则丁一定是水 |
| B、若X是盐酸,则丙一定是碳酸钙 |
| C、若X是二氧化碳,则乙一定是氢氧化钠 |
| D、若X是氢氧化钙,则丙一定是二氧化碳 |
具备化学知识会使我们的生活方式更加科学.下列说法不正确的是( )
| A、用硫酸铜溶液浸泡粽子叶,包出的粽子色泽艳丽,营养丰富 |
| B、利用高温杀毒的原因是能够破坏蛋白质的生理活性 |
| C、用洗洁精清洗餐具上的油污 |
| D、尼古丁是一种剧毒兴奋剂,会使吸烟者产生依赖,所以我们要拒绝烟草 |
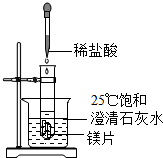 化学兴趣小组用如图装置进行实验,发现镁片完全溶解、石灰水浑浊.
化学兴趣小组用如图装置进行实验,发现镁片完全溶解、石灰水浑浊.
 水是最普通、最常见的物质之一.
水是最普通、最常见的物质之一.