题目内容
10.某化学兴趣活动小组的同学学习“灭火器原理”(如图)后,进行了如下的探究.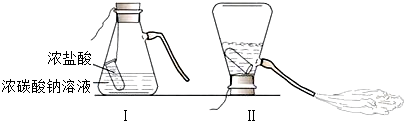
(1)锥形瓶中残留废液所含溶质是什么物质?
[猜想与假设]小华说:溶质可能是Na2CO3、NaCl和HCl;小李说:溶质可能是NaCl;小明说:溶质可能是Na2CO3和NaCl;小丽说溶质可能是:NaCl和HCl;
大家一致认为小华的猜想不正确,理由是碳酸钠和盐酸不能共存;
【初步验证】取少量试液滴加无色酚酞后不变色.
【查阅资料】溶液中氯离子遇到硝酸银溶液会产生只白色沉淀,Na2CO3溶液可使酚酞变红.
【得出结论】该溶质可能含有NaCl或NaCl和HCl;.
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量废液滴加少量硝酸银溶液 | 有白色沉淀产生 |
| ② | 另取适量废液,加入少量氧化铜 | 黑色粉末逐渐溶解,溶液逐渐变成蓝色 |
(2)小华思考:锥形瓶中废液怎么处理?
【拓展与应用】根据HCl的性质,无需另加试剂,要对废液进行蒸发操作即可从废液中得到NaCl固体.
分析 (1)【猜想与假设】根据碳酸钠和盐酸不能共存分析;
【得出结论】根据显酸性和显中性的溶液不能使酚酞试液变色分析;
【进行实验】根据盐酸和氯化钠溶液中都含有氯离子,遇到硝酸银溶液都会产生白色沉淀;盐酸能和氧化铜反应生成氯化铜和水写出反应的方程式;
(2)【拓展与应用】根据盐酸易挥发,蒸发氯化钠和氯化氢的混合溶液时,氯化氢溶液从溶液中挥发分析.
解答 解:(1)【猜想与假设】因为碳酸钠和盐酸不能共存,所以小华的猜想不正确;故填:碳酸钠和盐酸不能共存;
【得出结论】因为酚酞试液不变色,说明溶液中不含有碳酸钠,因此溶液中可能只有氯化钠,也可能含有氯化钠和盐酸,即该溶质可能含有NaCl,或NaCl和HCl;
故填:NaCl或NaCl和HCl;
【进行实验】由实验①不能确定溶质一定只含有氯化钠,理由是盐酸和氯化钠溶液中都含有氯离子,遇到硝酸银溶液都会产生白色沉淀;
根据实验②现象可知,小丽同学的猜想正确,氧化铜和盐酸发生反应的化学方程式为:CuO+2HCl=CuCl2+H2O;
故填:不能;盐酸和氯化钠溶液中都含有氯离子,遇到硝酸银溶液都会产生白色沉淀;小丽;CuO+2HCl=CuCl2+H2O;
(2)【拓展与应用】因为盐酸易挥发,所以无需另加试剂,只要对废液进行蒸发操作即可从废液中得到NaCl固体.
故填:蒸发.
点评 本题考查了碳酸钠与盐酸的反应以及碳酸钠和氯离子的检验,完成此题,可以依据碳酸钠和盐酸的性质以及常见离子的检验方法进行,要注意排除同类离子的干扰.

练习册系列答案
相关题目
1.最近科学家发现,水在-157℃超低温、正常压力或真空集条件下仍呈液态,比蜂蜜还粘稠,下列关于这种“高密度液态水”的说法正确的是( )
| A. | 化学性质与普通水不同 | B. | 分子不再运动 | ||
| C. | 分子间的间隔比普通水大 | D. | 氢、氧两种原子的个数比为2:1 |
15.对“大棚”农作物施用“汽水”(碳酸溶液),是近年来在种植生产中兴起的一新方法,对于其作用的下列几种叙述:①加速植物光合作用;②冬天有助于农作“防冻”③有利于改良酸性土壤,调节pH.期中正确的是( )
| A. | ①② | B. | ②③ | C. | ①③ | D. | 全部 |
10.碳酸镁晶须(MgCO3•nH2O,n=1-5的整数)广泛应用于冶金、耐火材料及化工产品等领域.为测定碳酸镁晶须中n的值,学习小组设计了如下装置并进行实验:(不考虑稀盐酸挥发)
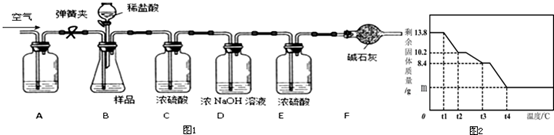
【查阅资料】:碳酸镁晶须受热分解,生成3种氧化物;
【实验步骤】①组装仪器,检查装置的气密性;②准确称取3.45g MgCO3•nH2O放在B装置中,连接仪器;③打开弹簧夹,鼓入一段时间空气,称量B、C、D、E、F装置的质量;④关闭弹簧夹,打开分液漏斗活塞,缓缓滴入稀盐酸至无气泡产生为止;⑤打开弹簧夹,鼓入一段时间空气;
⑥准确称量B、C、D、E、F装置的质量(如下表);
⑦根据数据进行计算.
【实验分析及数据处理】
(1)完善实验步骤:①检查装置的气密性;⑤鼓入一段时间空气;
(2)请计算碳酸镁晶须中的n值.(要求有计算过程,3分)
(3)A装置中盛放的溶液是NaOH(浓)溶液;
【实验反思】
(4)下列选项中,会造成实验结果偏大的是①⑤;偏小的是②③⑥;
①反应结束后,没有通空气;②滴入稀盐酸前,没有通空气;③没有A装置; ④D装置中NaOH溶液浓度过大;⑤稀盐酸滴加速率太快; ⑥没有C装置;
(5)为精确测定n的值,在老师指导下,小组同学称取13.8g MgCO3•nH2O进行热重分析,并绘制出如图所示的热重曲线示意图.则:
①t1℃至t2℃时,剩余固体质量不变的原因为没有达到该晶分解需要的温度;
②t1℃至t2℃时MgCO3•nH2O分解的化学方程式为:MgCO3•3H2O═MgCO3•H2O+2H2O;
③完全反应后,剩余固体的质量m为4g.

【查阅资料】:碳酸镁晶须受热分解,生成3种氧化物;
【实验步骤】①组装仪器,检查装置的气密性;②准确称取3.45g MgCO3•nH2O放在B装置中,连接仪器;③打开弹簧夹,鼓入一段时间空气,称量B、C、D、E、F装置的质量;④关闭弹簧夹,打开分液漏斗活塞,缓缓滴入稀盐酸至无气泡产生为止;⑤打开弹簧夹,鼓入一段时间空气;
| B | C | D | E | F | |
| 反应前 | 122.0g | 250.0g | 300.0g | 350.0g | 330.0g |
| 反应后 | 120.6g | 250.2g | 301.0g | 350.1g | 332.0g |
⑦根据数据进行计算.
【实验分析及数据处理】
(1)完善实验步骤:①检查装置的气密性;⑤鼓入一段时间空气;
(2)请计算碳酸镁晶须中的n值.(要求有计算过程,3分)
(3)A装置中盛放的溶液是NaOH(浓)溶液;
【实验反思】
(4)下列选项中,会造成实验结果偏大的是①⑤;偏小的是②③⑥;
①反应结束后,没有通空气;②滴入稀盐酸前,没有通空气;③没有A装置; ④D装置中NaOH溶液浓度过大;⑤稀盐酸滴加速率太快; ⑥没有C装置;
(5)为精确测定n的值,在老师指导下,小组同学称取13.8g MgCO3•nH2O进行热重分析,并绘制出如图所示的热重曲线示意图.则:
①t1℃至t2℃时,剩余固体质量不变的原因为没有达到该晶分解需要的温度;
②t1℃至t2℃时MgCO3•nH2O分解的化学方程式为:MgCO3•3H2O═MgCO3•H2O+2H2O;
③完全反应后,剩余固体的质量m为4g.


 下列选项符合图示包含关系的是( )
下列选项符合图示包含关系的是( ) 