题目内容
10.碳酸镁晶须(MgCO3•nH2O,n=1-5的整数)广泛应用于冶金、耐火材料及化工产品等领域.为测定碳酸镁晶须中n的值,学习小组设计了如下装置并进行实验:(不考虑稀盐酸挥发)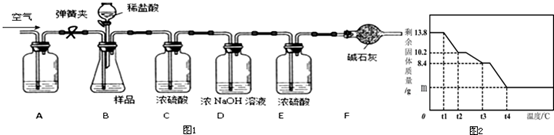
【查阅资料】:碳酸镁晶须受热分解,生成3种氧化物;
【实验步骤】①组装仪器,检查装置的气密性;②准确称取3.45g MgCO3•nH2O放在B装置中,连接仪器;③打开弹簧夹,鼓入一段时间空气,称量B、C、D、E、F装置的质量;④关闭弹簧夹,打开分液漏斗活塞,缓缓滴入稀盐酸至无气泡产生为止;⑤打开弹簧夹,鼓入一段时间空气;
| B | C | D | E | F | |
| 反应前 | 122.0g | 250.0g | 300.0g | 350.0g | 330.0g |
| 反应后 | 120.6g | 250.2g | 301.0g | 350.1g | 332.0g |
⑦根据数据进行计算.
【实验分析及数据处理】
(1)完善实验步骤:①检查装置的气密性;⑤鼓入一段时间空气;
(2)请计算碳酸镁晶须中的n值.(要求有计算过程,3分)
(3)A装置中盛放的溶液是NaOH(浓)溶液;
【实验反思】
(4)下列选项中,会造成实验结果偏大的是①⑤;偏小的是②③⑥;
①反应结束后,没有通空气;②滴入稀盐酸前,没有通空气;③没有A装置; ④D装置中NaOH溶液浓度过大;⑤稀盐酸滴加速率太快; ⑥没有C装置;
(5)为精确测定n的值,在老师指导下,小组同学称取13.8g MgCO3•nH2O进行热重分析,并绘制出如图所示的热重曲线示意图.则:
①t1℃至t2℃时,剩余固体质量不变的原因为没有达到该晶分解需要的温度;
②t1℃至t2℃时MgCO3•nH2O分解的化学方程式为:MgCO3•3H2O═MgCO3•H2O+2H2O;
③完全反应后,剩余固体的质量m为4g.
分析 (1)根据实验目的分析实验步骤;
(2)根据二氧化碳与碳酸镁晶体的质量关系进行分析;
(3)根据实验目的分析氢氧化钠溶液的作用;
(4)根据操作步骤引起的二氧化碳质量的变化分析对n值的影响;
(5)根据图象分析晶体分解过程、以及书写化学方程式.
解答 解:(1)有气体生成的装置必须先检查装置的气密性,通过碳酸镁晶体与盐酸反应产生二氧化碳的质量确定n的值,实验前应将装置中的二氧化碳排净,因此先将除去二氧化碳的空气鼓入装置,要除去空气中二氧化碳,可将空气通过氢氧化钠溶液吸收,然后关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止,打开弹簧夹a,缓缓鼓入空气,使产生的二氧化碳全部排到C装置中,C装置增重的质量即为生成的二氧化碳的质量;
(2)3次实验C装置平均增重:$\frac{1.1g+1.11g+1.09g}{3}$=1.1g,
MgCO3•nH2O~CO2
84+18n 44
3.45g 1.1g
$\frac{84+18n}{3.45g}$=$\frac{44}{1.1g}$
解得:n=3;
(3)由上述分析可知A装置内盛的是氢氧化钠溶液,以吸收空气中的二氧化碳,防止对生成二氧化碳质量的干扰;
(4)①反应结束后,没有通空气,产生的二氧化碳没有全部排到C装置,使二氧化碳的质量偏小,引起结果偏大;
②滴入稀盐酸前,没有通空气,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小;
③没有A装置,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小;
④D装置中NaOH溶液浓度过大,不会影响二氧化碳的质量,对结果没有影响;
⑤稀盐酸滴加速率太快,产生的二氧化碳没有全部被C装置吸收,使二氧化碳的质量偏小,引起结果偏大;
⑥没有C装置,水蒸气会进入D装置中,使二氧化碳的质量偏大,引起结果偏小;
(5)①通过分析可知,t1℃至t2℃时,剩余固体质量不变的原因为:没有达到该晶分解需要的温度;
②由第(2)问计算可知该晶体的化学式为MgCO3•3H2O,由图象可知该晶体分解过程先分解生成水,当结晶水全部失去后碳酸镁分解生成氧化镁和水,设t2℃时,剩余固体化学式为MgCO3•xH2O,则此时分解的化学方程式为
MgCO3•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•xH2O+(3-x)H2O
138 84+x×18
13.8g 10.2g
$\frac{138}{13.8g}$=$\frac{84+18x}{10.2g}$
x=1
所以t1℃至t2℃时MgCO3•nH2O分解的化学方程式为:MgCO3•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•H2O+2H2O;
③根据分解过程可知最终分解过程是碳酸镁完全分解生成氧化镁和水,因此最终固体是氧化镁,化学式为MgO,所以
MgCO3•3H2O----MgO
138 40
13.8g 4g
所以完全反应后,剩余固体的质量m为4g.
故答案为:(1)①检查装置的气密性,⑤鼓入一段时间空气;
(2)n=3;
(3)NaOH(浓)溶液;
(4)①⑤,②③⑥;
(5)①没有达到该晶分解需要的温度;
②MgCO3•3H2O═MgCO3•H2O+2H2O;
③4g.
点评 本题考查通过分析实验数据测定物质组成,要注意保证产生的二氧化碳全部被吸收,同时要排除装置内空气中的二氧化碳进入C装置.

| A. | 反应后固体物质的组成中一定有银、铜、镁,可能有锌 | |
| B. | 向滤液中滴加NaCl溶液,可能与不溶于稀HNO3的白色沉淀生成 | |
| C. | 反应后固体物质中一定有银、铜、锌、镁 | |
| D. | 滤液中一定含有Mg2+,可能含有Zn2+ |
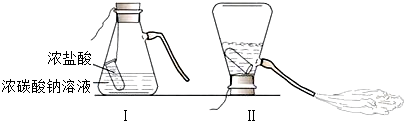
(1)锥形瓶中残留废液所含溶质是什么物质?
[猜想与假设]小华说:溶质可能是Na2CO3、NaCl和HCl;小李说:溶质可能是NaCl;小明说:溶质可能是Na2CO3和NaCl;小丽说溶质可能是:NaCl和HCl;
大家一致认为小华的猜想不正确,理由是碳酸钠和盐酸不能共存;
【初步验证】取少量试液滴加无色酚酞后不变色.
【查阅资料】溶液中氯离子遇到硝酸银溶液会产生只白色沉淀,Na2CO3溶液可使酚酞变红.
【得出结论】该溶质可能含有NaCl或NaCl和HCl;.
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量废液滴加少量硝酸银溶液 | 有白色沉淀产生 |
| ② | 另取适量废液,加入少量氧化铜 | 黑色粉末逐渐溶解,溶液逐渐变成蓝色 |
(2)小华思考:锥形瓶中废液怎么处理?
【拓展与应用】根据HCl的性质,无需另加试剂,要对废液进行蒸发操作即可从废液中得到NaCl固体.
(1)硬水给生活和生产带来很多麻烦,生活中可用肥皂水来区分硬水和软水;
(2)我国是淡水资源非常有限的国家,爱护水资源是每个公民的责任和义务.下列行为属于浪费水的是AD(填字母编号);
A.洗手擦香皂时不关上水龙头 B.用洗菜水浇花
C.用洗衣水冲厕所 D.用自来水不断为西瓜冲水降温.
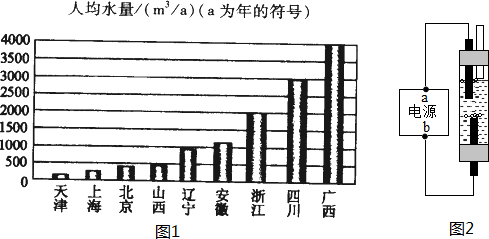
(3)资料一:我国部分省市人均水量图(如图1)
资料二:水资源紧缺指标
| 紧 缺 性 | 轻度缺水 | 中度缺水 | 重度缺水 | 极度缺水 |
| 人均水量(m3/a) | 1700-3000 | 1000-1700 | 500-1000 | <500 |
(4)如图2是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气(Cl2),该反应的文字表达式为氯化钠+水$\stackrel{通电}{→}$氢氧化钠+氢气+氯气;从能量变化角度看,该反应将电能转化为化学能.
| A. | 硫在氧气中燃烧发出明亮蓝紫色火焰 | |
| B. | 浓盐酸敞口放置在空气中瓶口猫“白雾” | |
| C. | 铁丝在氧气中燃烧生成白色固体四氧化三铁 | |
| D. | 红磷在氧气中燃烧产生白烟 |
 实验室里有一瓶标签残缺的试剂瓶,标签中只剩下“Na”和“10%”字样(如图所示),某兴趣小组对其组成员进行如下探究.
实验室里有一瓶标签残缺的试剂瓶,标签中只剩下“Na”和“10%”字样(如图所示),某兴趣小组对其组成员进行如下探究.【提出问题】这瓶试剂可能是什么溶液呢?
【查阅资料】
Ⅰ.初中化学中常见含钠的化合物有:NaCl、NaOH、Na2CO3、NaHCO3,其中一 种物质的类别有别于其它三种物质,该物质是氢氧化钠或NaOH.
Ⅱ.NaHCO3的水溶液呈碱性.
Ⅲ.室温(20℃)时,四种物质的溶解度数据如下:
| 物质 | NaHCO3 | NaCl | NaOH | Na2CO3 |
| 溶解度g/100g水 | 9.6 | 36 | 109 | 215 |
依据上述资料分析该瓶试剂不可能是碳酸氢钠的原因是20℃时饱和的碳酸氢钠溶液也达不到10%的浓度.
【实验探究】
实验1:实验测得该溶液的pH>7,则这瓶试剂也不可能是氯化钠.
实验2:为了检验该溶液是NaOH溶液还是Na2CO3溶液,又进行了如下实验:
取少量溶液于试管中,滴加足量的盐酸,有气泡产生,得出结论,该溶液是Na2CO3溶液.写出上述反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
有同学对上述结论提出质疑,他认为该溶液可能由氢氧化钠和碳酸钠组成,并设计如下实验.
实验3:另取样,加入过量的CaCl2溶液(呈中性),观察到有白色沉淀产生,设计这一步骤的目的是检验并除尽碳酸钠;静置后,取上层清液,滴入酚酞试液,溶液呈红色;得出结论,该同学的假设成立.
上述实验中,证明所加氯化钙溶液是过量的方法是取实验3中上层清夜,滴加碳酸钠溶液,有白色沉淀产生,说明氯化钙是过量的.
 某化学兴趣小组设计了一组“吹气球”实验,装置如图:
某化学兴趣小组设计了一组“吹气球”实验,装置如图: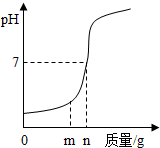 (1)用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示.熟石灰与盐酸反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H20;当加入熟石灰m g时,溶液中的溶质为CaCl2和HCl.若改用n g氢氧化钠与相同量盐酸反应,所得溶液的pH<7(填“>”“<”或“=”).
(1)用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示.熟石灰与盐酸反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H20;当加入熟石灰m g时,溶液中的溶质为CaCl2和HCl.若改用n g氢氧化钠与相同量盐酸反应,所得溶液的pH<7(填“>”“<”或“=”).