题目内容
4.孔雀石主要含Cu2(OH)2CO3,还含少量Fe2O3、SiO2,实验室以孔雀石为原料制CuSO4•5H2O及CaCO3,步骤如下:请回答下列问题:
(1)反应Ⅰ硫酸需过量的原因是使碱式碳酸铜和氧化铁完全反应.
(2)溶液A中含有的溶质是硫酸铜、硫酸铁等.(填两种即可)
(3)完成操作1、操作2所需的仪器有acfg.

(4)由溶液B获得CuSO4•5H2O,需要经过加热浓缩、加热蒸发、过滤等操作.
(5)请将反应Ⅱ的主要反应方程式补充完整:CO2+CaCl2+2NH3•H2O=CaCO3↓+2NH4Cl+H2O,应向CaCl2溶液中先加入(或先通入)氨水,(选填“CO2”或“氨水”)原因是使二氧化碳吸收完全从反应Ⅱ所得CaCO3需经过“洗涤”这步操作,判断沉淀已洗涤干净的操作方法是:取最后一次洗涤液滴加硝酸银溶液,若无白色沉淀,则已洗净.
分析 (1)根据碱式碳酸铜和氧化铁会与硫酸反应生成硫酸铜和硫酸铁进行分析;
(2)根据硫酸和孔雀石反应后生成了硫酸铜和硫酸铁进行分析;
(3)根据操作1、操作2可以将固体和液体分离,所以操作1、2是过滤操作,以及过滤操作需要的仪器进行分析;
(4)根据由滤液A获得CuSO4•5H2O,需加热蒸发、冷却结晶、过滤等操作进行分析;
(5)根据氨水显碱性,二氧化碳是酸性气体,以及氯离子和银离子会生成氯化银沉淀进行分析.
解答 解:(1)碱式碳酸铜和氧化铁会与硫酸反应生成硫酸铜和硫酸铁,所以反应Ⅰ硫酸需过量的原因是:使碱式碳酸铜和氧化铁完全反应;
(2)硫酸和孔雀石反应后生成了硫酸铜和硫酸铁,所以溶液A中含有的溶质是:硫酸铜、硫酸铁;
(3)操作1、操作2可以将固体和液体分离,所以操作1、2是过滤操作,过滤需要的仪器有:烧杯、漏斗、玻璃棒、铁架台等,故选:acfg;
(4)由滤液A获得CuSO4•5H2O,需加热蒸发、冷却结晶、过滤等操作;
(5)氨水显碱性,二氧化碳是酸性气体,所以应向CaCl2溶液中先加入氨水,原因是:使二氧化碳吸收完全,氯离子和银离子会生成氯化银沉淀,所以判断沉淀已洗涤干净的操作方法是:取最后一次洗涤液滴加硝酸银溶液,若无白色沉淀,则已洗净.
故答案为:(1)使碱式碳酸铜和氧化铁完全反应;
(2)硫酸铜、硫酸铁;
(3)acfg;
(4)加热蒸发;
(5)氨水,使二氧化碳吸收完全,硝酸银.
点评 本题考查以孔雀石为原料制备CuSO4•5H2O及CaCO3的实验流程,要根据已有知识弄清各步操作然后结合所学知识和题中信息解答.

练习册系列答案
相关题目
20.实验前恰当处理实验用品是保证实验成功的关键,下列处理方法中,不正确的是( )
| A. | 用pH试纸测定溶液的酸碱度,需先将试纸用水润湿 | |
| B. | 配制一定质量分数的氯化钠溶液,所用烧杯需要干燥 | |
| C. | 做铁丝与硫酸铜溶液反应实验,铁丝需要用砂纸打磨 | |
| D. | 进行过滤操作,需先将滤纸折成圆锥形后放在漏斗中润湿使之紧贴漏斗内壁 |
19. 碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.
碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.
【查阅资料】
(1)碳酸钠和碳酸氢钠在不同温度下的溶解度
(2)碳酸钠和碳酸氢钠化学性质(部分)的比较
【设计方案并实施】
【实验反思】
(1)通过上述实验,我们知道依据物质的性质设计并进行对比实验,能帮助我们更好地理解和掌握相关物理的性质.
(2)在两种物质中,我们一般选用碳酸氢钠来治疗胃酸过多.理由是碳酸氢钠比碳酸钠碱性弱,比较安全.
(3)方案二中,为何都配制成质量分数相同的溶液?溶液浓度的不同,会导致溶液pH值的不同
(4)请写出方案四中任意反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑.
 碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.
碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.【查阅资料】
(1)碳酸钠和碳酸氢钠在不同温度下的溶解度
| 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3 | 12.5 g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.lg | 12.7g |
| 性质 | Na2CO3 | NaHCO3 | 性质比较 |
| 溶液的酸碱性 | 碱性 | 碱性 | 相同条件下,Na2C03溶液的碱性更强 |
| 热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2C03、C02 和H20 |
| 与盐酸反应 | 反应 | 反应 | 均产生CO2,但NaHCO3与盐酸的反应更加剧烈 |
| 实验方案 | 实验现象及结论 1 |
| 方案一:20℃时,在100g水中加入11g该白色固体,充分溶解 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
| 方案二:分别将两种白色固体溶于水制成5%的溶液,用玻璃棒分别蘸取少量待测液于pH试纸上,将其与标准比色板对照. | pH值小的为碳酸氢钠溶液. |
| 方案三:分却取少量固体于試管中加热,然后将产生的气体通入石灰水中. | 能产生使石灰水变浑浊的气体的是碳酸氢钠. |
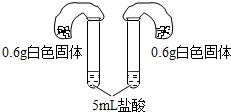
| 方案四:如图所示,分别将气球中的固体粉末全部且同时倒入装有过量盐酸的试管中,观察现象. | 1.试管中剧烈反应,反应更加剧烈的是碳酸氢钠; 2.反应后两气球鼓起,鼓起较大的是碳酸氢钠. |
(1)通过上述实验,我们知道依据物质的性质设计并进行对比实验,能帮助我们更好地理解和掌握相关物理的性质.
(2)在两种物质中,我们一般选用碳酸氢钠来治疗胃酸过多.理由是碳酸氢钠比碳酸钠碱性弱,比较安全.
(3)方案二中,为何都配制成质量分数相同的溶液?溶液浓度的不同,会导致溶液pH值的不同
(4)请写出方案四中任意反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑.
9.下列洗涤方法中利用了乳化原理的是( )
| A. | 用稀盐酸洗去水壶内的水垢 | B. | 用汽油洗去手上的油污 | ||
| C. | 用酒精洗去试管中的碘 | D. | 洗洁精洗去餐具上的油污 |
 “石头纸”也叫石科纸.2010年两会期间,政协委员们领到的会议通知、日程表、便签纸等都是以碳酸钙为主要原料(假设其它物质不溶于水也不参加反应)的低碳“石头纸”.我校化学兴趣小组的同学对这种“石头纸”产生了浓厚的兴趣,进行了如下实验:
“石头纸”也叫石科纸.2010年两会期间,政协委员们领到的会议通知、日程表、便签纸等都是以碳酸钙为主要原料(假设其它物质不溶于水也不参加反应)的低碳“石头纸”.我校化学兴趣小组的同学对这种“石头纸”产生了浓厚的兴趣,进行了如下实验: