题目内容
19. 碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.
碳酸钠和碳酸氢钠是生活中常见的两种白色固体,同学们对鉴别这两种物质非常感兴趣,进行如下探究.【查阅资料】
(1)碳酸钠和碳酸氢钠在不同温度下的溶解度
| 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3 | 12.5 g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.lg | 12.7g |
| 性质 | Na2CO3 | NaHCO3 | 性质比较 |
| 溶液的酸碱性 | 碱性 | 碱性 | 相同条件下,Na2C03溶液的碱性更强 |
| 热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2C03、C02 和H20 |
| 与盐酸反应 | 反应 | 反应 | 均产生CO2,但NaHCO3与盐酸的反应更加剧烈 |
| 实验方案 | 实验现象及结论 1 |
| 方案一:20℃时,在100g水中加入11g该白色固体,充分溶解 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
| 方案二:分别将两种白色固体溶于水制成5%的溶液,用玻璃棒分别蘸取少量待测液于pH试纸上,将其与标准比色板对照. | pH值小的为碳酸氢钠溶液. |
| 方案三:分却取少量固体于試管中加热,然后将产生的气体通入石灰水中. | 能产生使石灰水变浑浊的气体的是碳酸氢钠. |
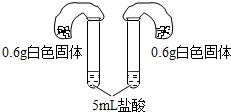
| 方案四:如图所示,分别将气球中的固体粉末全部且同时倒入装有过量盐酸的试管中,观察现象. | 1.试管中剧烈反应,反应更加剧烈的是碳酸氢钠; 2.反应后两气球鼓起,鼓起较大的是碳酸氢钠. |
(1)通过上述实验,我们知道依据物质的性质设计并进行对比实验,能帮助我们更好地理解和掌握相关物理的性质.
(2)在两种物质中,我们一般选用碳酸氢钠来治疗胃酸过多.理由是碳酸氢钠比碳酸钠碱性弱,比较安全.
(3)方案二中,为何都配制成质量分数相同的溶液?溶液浓度的不同,会导致溶液pH值的不同
(4)请写出方案四中任意反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑.
分析 【设计方案并实施】根据对碳酸钠与碳酸氢钠性质差别的认识,利用两物质性质的不同,设计实验鉴别两种物质;
【实验反思】(1)根据实验现象经过对比,可以更好的理解和记忆物质的性质;
(2)根据碳酸氢钠的碱性比碳酸钠弱进行分析;
(3)根据溶液浓度的不同,会导致溶液的pH值不同进行分析;
(4)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行分析.
解答 解:【设计方案并实施】可利用碳酸钠和碳酸氢钠在不同温度下的溶解度;碳酸钠与盐酸反应时会先生成碳酸氢钠而不会马上产生二氧化碳气体、碳酸氢钠受热能分解出气体二氧化碳或两物质所得溶液的酸碱性强弱有明显差异等性质,分别进行滴加盐酸、加热或测溶液pH等对比实验,进行鉴别,所以:
| 实验方案 | 实验现象及结论 |
| 方案一:20℃时,在100g水中加入11g该白色固体,充分溶解 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
| 方案二:分别将两种待测固体溶于水制成5%的溶液,用玻璃棒分别蘸取少量待测液于pH试纸上,将其与标准比色板对照 | pH值小的为碳酸氢钠溶液. |
| 方案三:分却取少量固体于試管中加热,将产生的气体通入澄清的石灰水中. | 若石灰水变浑浊,样品为碳酸氢钠,否则为碳酸钠. |
| 方案四:如阁所示,分别将气球中的白色固体全部且同时倒入装有盐酸的试管中,观察现象. | 1.试管中剧烈反应,反应更加剧烈的是碳酸氢钠, 2.反应后两气球鼓起,鼓起较大的是碳酸氢钠. |
(2)一般选用碳酸氢钠来治疗胃酸过多,理由是:碳酸氢钠比碳酸钠碱性弱,比较安全;
(3)溶液浓度的不同,会导致溶液pH值的不同,为了验证pH值的不同,需要控制变量,所以都配制成质量分数相同的溶液;
(4)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
故答案为:【设计方案并实施】
| 实验方案 | 实验现象及结论 |
| 20℃时,在100g水中加入11g该白色固体,充分溶解 | |
| 用玻璃棒分别蘸取少量待测液于pH试纸上 | 碳酸氢钠 |
| 碳酸氢钠 | |
| 碳酸氢钠, 碳酸氢钠. |
(2)碳酸氢钠比碳酸钠碱性弱,比较安全;
(3)溶液浓度的不同,会导致溶液pH值的不同;
(4)Na2CO3+2HCl=2NaCl+H2O+CO2↑.
点评 本题考查物质的鉴别,学生应注意利用物质性质的差异,多种方法并用来鉴别物质,将反应、现象、计算相结合来分析解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列物质必须密封保存的是( )
| A. | 黄金 | B. | 浓盐酸 | C. | 石灰石 | D. | 氯化钠 |
7.下列括号中对日常生活的变化判断正确的是( )
| A. | 酿酒过程(化学变化) | |
| B. | 玻璃窗破裂(化学变化) | |
| C. | 二氧化碳使澄清的石灰水变浑浊(物理变化) | |
| D. | 汽油挥发(化学变化) |
8. 如图是木炭还原氧化铜的探究实验装置.
如图是木炭还原氧化铜的探究实验装置.
【提出问题】木炭还原氧化铜产生什么气体?
【提出猜想】产生的气体有三种情况:①CO ②CO2 ③CO和CO2.
【设计方案】实验前后分别对试管和烧杯里的物质进行称量,数据设计如下:
(1)若△m2=0,说明反应产生的气体不被澄清石灰水吸收,则猜想①成立.
(2)若猜想②正确,理论上△m1与△m2 的关系是:△m1=△m2(填“>”、“<”或“=”)
【实验并记录】实验得到的数据如下表:
用以上实验数据分析,结果应该是猜想③ 成立.
【反思与评价】经查阅资料知道:木炭还原氧化铜时是产生CO2气体,即反应的化学方程式为:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
(1)本次实验结果与资料结果不一致.对其可能原因有同学提出下列分析:
A.装置漏气 B.生成的CO2部分与过量的C反应生成了CO
C.澄清石灰水吸收CO2效果不好 D.装置内还有CO2气体未被吸收
你认为上述分析中合理的是ABCD.
(2)针对分析C,为了提高CO2的吸收效果,可以改进实验,改进的方法是用氢氧化钠溶液代替澄清石灰水.
 如图是木炭还原氧化铜的探究实验装置.
如图是木炭还原氧化铜的探究实验装置.【提出问题】木炭还原氧化铜产生什么气体?
【提出猜想】产生的气体有三种情况:①CO ②CO2 ③CO和CO2.
【设计方案】实验前后分别对试管和烧杯里的物质进行称量,数据设计如下:
| 称量对象 | 反应前质量 | 反应后质量 | 质量差 |
| 试管+固体混合物 | M1 | M2 | △m1即( M1-M2) |
| 烧杯+澄清石灰水 | M3 | M4 | △m2即( M4-M3) |
(2)若猜想②正确,理论上△m1与△m2 的关系是:△m1=△m2(填“>”、“<”或“=”)
【实验并记录】实验得到的数据如下表:
| 称量对象 | 反应前质量 | 反应后质量 | 质量差 |
| 试管+固体混合物 | 69.8g | 65.4g | △m1 |
| 烧杯+澄清石灰水 | 118.8g | 122.6g | △m2 |
【反思与评价】经查阅资料知道:木炭还原氧化铜时是产生CO2气体,即反应的化学方程式为:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
(1)本次实验结果与资料结果不一致.对其可能原因有同学提出下列分析:
A.装置漏气 B.生成的CO2部分与过量的C反应生成了CO
C.澄清石灰水吸收CO2效果不好 D.装置内还有CO2气体未被吸收
你认为上述分析中合理的是ABCD.
(2)针对分析C,为了提高CO2的吸收效果,可以改进实验,改进的方法是用氢氧化钠溶液代替澄清石灰水.
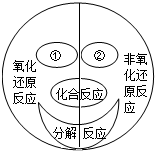 广义的氧化还原反应是指:在反应前后有元素化合价发生变化的化学反应都属于氧化还原反应.如图是小明构建的四种基本反应类型与氧化还原反应的关系图.根据此图回答下列问题:
广义的氧化还原反应是指:在反应前后有元素化合价发生变化的化学反应都属于氧化还原反应.如图是小明构建的四种基本反应类型与氧化还原反应的关系图.根据此图回答下列问题: 维生素C主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗力.计算:人体缺乏维生素C(简称Vc),就会患坏血病.如图是盛放“维生素C”瓶子的标签的一部分,其中维生素C的化学式部分不满,可用C6H8O6表示.根据表中信息回答:
维生素C主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗力.计算:人体缺乏维生素C(简称Vc),就会患坏血病.如图是盛放“维生素C”瓶子的标签的一部分,其中维生素C的化学式部分不满,可用C6H8O6表示.根据表中信息回答:
