题目内容
10.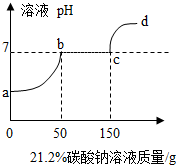 往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:(1)a→b段表示碳酸钠与混合溶液中的稀盐酸反应;
(2)反应到c点时,所得溶液的溶质质量分数是多少?(写出计算过程,精确到0.1%)
分析 (1)根据盐酸和氯化钙的混合溶液中,滴加稀盐酸,盐酸会先于碳酸钠,溶液的pH值升高,然后碳酸钠再与氯化钙反应,溶液的pH值不变,反应结束,溶液的pH值会继续的增大进行分析;
(2)根据图象中所给的数据,以及题中的反应原理进行分析计算.
解答 解:(1)盐酸和氯化钙的混合溶液中,滴加稀盐酸,盐酸会先于碳酸钠,溶液的pH值升高,然后碳酸钠再与氯化钙反应,溶液的pH值不变,反应结束,溶液的pH值会继续的增大,所以a→b段表示碳酸钠与混合溶液中的稀盐酸反应;
(2)设盐酸和碳酸钠反应时,生成氯化钠质量为x,生成二氧化碳质量为y
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 117 44
21.2%×50g x y
$\frac{106}{21.2%×50g}$=$\frac{117}{x}$=$\frac{44}{y}$
x=11.7g
y=4.4g
碳酸钠和氯化钙反应生成氯化钠质量为m,生成碳酸钙沉淀质量为n
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 100 117
21.2%×100g n m
$\frac{106}{21.2%×100g}$=$\frac{100}{n}$=$\frac{117}{m}$
m=23.4g
n=20g
所以所得溶液的溶质质量分数是$\frac{23.4g+11.7g}{100g+150g-20g-4.4g}$×100%=15.6%.
故答案为:(1)稀盐酸;
(2)所得溶液的溶质质量分数是15.6%.
点评 在解此类题时,首先分析反应应用的原理,然后结合图象中的转折点,以及方程式中的比例关系进行解答.

(1)某化学兴趣小组从市场获取少量混合物A于烧杯中,缓慢加入足量的蒸馏水,边加边搅拌,静置,过滤得滤液.
①该过程发生反应的化学方程式为CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
②滤液中除含有Cl-、OH-外,还含有的阴离子是CO32-.
(2)在混合物A中加入少量ZnSO4可改善皮蛋品质,该兴趣小组获得某样品,探究在混合物A中是否添加了少量ZnSO4.
设计实验方案,完成如表表格.
限选用品与试剂:稀盐酸、pH试纸、BaC12溶液、蒸馏水、AgNO3溶液.
| 实验操作 | 预期现象和必要结论 |
| 步骤1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤 | / |
| 步骤2:取少量步骤1所得的滤液于试管中,向其中加入足量的稀盐酸,振荡,观察现象.. | 有气泡生成 |
| 步骤3:向步骤2反应后溶液中滴入少量的BaCl2溶液,观察现. | 若有白色沉淀生成,说明样品中有ZnSO4; 若无明显现象,说明样品中没有ZnSO4. |
| A. | 出行多选择自行车和公交车 | B. | 大量使用塑料袋方便购物 | ||
| C. | 植树造林,增加城市绿地面积 | D. | 对垃圾分类,回收利用 |
| A. | 硫-单质 | B. | 纯碱-碱 | C. | 酒精-有机化合物 | D. | 生石灰-氧化物 |
 如图是镁元素在元素周期表的信息和原子结构示意图,下列判断不正确的是( )
如图是镁元素在元素周期表的信息和原子结构示意图,下列判断不正确的是( )| A. | 一个镁原子的质量是24.31g | |
| B. | 镁原子有12个质子 | |
| C. | 镁原子在化学反应中易失去2个电子 | |
| D. | 镁元素在化合物中显正价 |
| A. | 碳酸氢钠 | B. | 生石灰 | C. | 氢氧化钠 | D. | 氯化钠 |
| A. | 空气、氢氧化钠、水 | B. | 液氧、纯碱、空气 | ||
| C. | 生铁、石油、干冰 | D. | 矿泉水、熟石灰、高锰酸钾 |
| A. | 金刚石刀切割玻璃 | B. | 用粮食发酵酿酒 | ||
| C. | 生石灰吸水变成粉末 | D. | 铁矿石在高炉中炼铁 |