题目内容
2.分类是学习化学的方法之一,下列物质按混合物,碱,氧化物的顺序排列的是( )| A. | 空气、氢氧化钠、水 | B. | 液氧、纯碱、空气 | ||
| C. | 生铁、石油、干冰 | D. | 矿泉水、熟石灰、高锰酸钾 |
分析 混合物是由多种物质组成;碱是电离出的阴离子全部都是氢氧根离子的化合物;氧化物是由两种元素组成,一种是氧元素的化合物,据此分析.
解答 解:A、空气中含有氧气、氮气等属于混合物;氢氧化钠属于碱;水属于氧化物,故A正确;
B、液氧属于单质;纯碱是碳酸钠,属于盐;空气属于混合物,故B错;
C、生铁是混合物;石油属于混合物;干冰是二氧化碳的固体,属于氧化物,故C错;
D、矿泉水属于混合物;熟石灰属于碱;高锰酸钾属于盐,故D错.
故选A.
点评 要根据碱、氧化物、混合物的概念回答本题,要把握要点,知道常见物质的组成.

练习册系列答案
相关题目
17.下列有关氧气的说法,不正确的是( )
| A. | 用燃烧法来测定空气中氧气的含量,可燃物常用红磷 | |
| B. | 氧气约占空气体积的21% | |
| C. | 用带火星的木条是否复燃来检验氧气 | |
| D. | 鱼能在水中生活,证明氧气易溶于水 |
7.下列物质混合能发生反应的是( )
| A. | 银与稀盐酸 | B. | 铜与硫酸锌溶液 | C. | 铁与稀硫酸 | D. | 锌与硫酸镁溶液 |
11. 甲、乙、丙和X、Y、Z都是初中化学中常见的物质,甲、乙、丙都是氧化物,且常温下甲固体,乙是气体,丙是液体.在一定条件下,甲、乙、丙之间存在如图所示的转化关系(反应条件和部分生成物已略去).下列判断正确的是( )
甲、乙、丙和X、Y、Z都是初中化学中常见的物质,甲、乙、丙都是氧化物,且常温下甲固体,乙是气体,丙是液体.在一定条件下,甲、乙、丙之间存在如图所示的转化关系(反应条件和部分生成物已略去).下列判断正确的是( )
 甲、乙、丙和X、Y、Z都是初中化学中常见的物质,甲、乙、丙都是氧化物,且常温下甲固体,乙是气体,丙是液体.在一定条件下,甲、乙、丙之间存在如图所示的转化关系(反应条件和部分生成物已略去).下列判断正确的是( )
甲、乙、丙和X、Y、Z都是初中化学中常见的物质,甲、乙、丙都是氧化物,且常温下甲固体,乙是气体,丙是液体.在一定条件下,甲、乙、丙之间存在如图所示的转化关系(反应条件和部分生成物已略去).下列判断正确的是( )| A. | 甲一定是CuO | B. | X一定具有还原性 | ||
| C. | Z一定是酸 | D. | Y和Z一定能发生反应 |
14.图1所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来.图2、图3是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强-时间关系图(该装置气密性良好,p0是集气瓶内初始气压,p和p′分别是反应结束后恢复到室温时集气瓶内的气压).下列说法正确的是( )
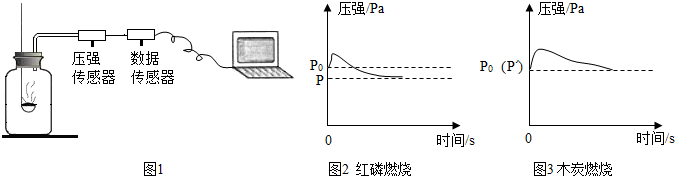

| A. | 燃烧匙内所装红磷或木炭的多少对实验结果无影响 | |
| B. | 反应开始时集气瓶中压强瞬间变大的是由燃烧放热造成的 | |
| C. | p=0.79p0,p′=p0是因为红磷的着火点比木炭低 | |
| D. | 由图3可推出空气中氧气的含量 |
 向100g硫酸铜溶液中,逐滴加入NaOH溶液,化学反应方程式为:
向100g硫酸铜溶液中,逐滴加入NaOH溶液,化学反应方程式为: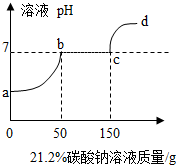 往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算: