题目内容
17.某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图甲所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.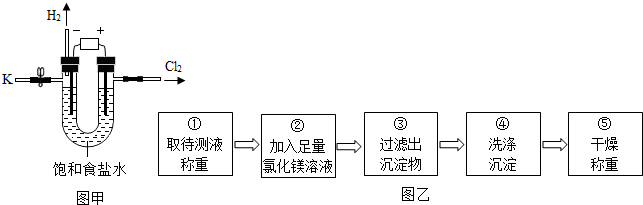
老师提示:
Ⅰ.电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
取样,滴加几滴无色酚酞试液 | 溶液变红色 | 待测液呈碱性,表明含有氢氧化钠 |
【实验】用沉淀法测定
资料摘要:氢氧化钠能与氯化镁溶液发生反应:同学们按如图乙所示的实验步骤进行实验.
(2)步骤②加入的氯化镁溶液必需足量,其目的是使NaOH完全反应;滴加硝酸银溶液,若无白色沉淀生成,说明沉淀物已洗净,反之则没有洗净.
步骤④中判断沉淀物是否洗净的具体操 作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,若无白色沉淀生成,说明沉淀物已洗净,反之则没有洗净(写出实验步骤、现象和结论).
(3)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(4)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
分析 (1)氢氧化钠溶液显碱性,能使酚酞试液变红色;
(2)为了使氢氧化钠溶液中的氢氧化钠和氯化镁完全反应,氯化镁溶液应该是足量的;
(3)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,因此步骤③过滤出的沉淀物是氢氧化镁;
(4)利用沉淀物的质量计算氢氧化钠的质量分数时,若不洗涤沉淀,那么沉淀上会附着一些杂质,从而使沉淀的质量增大,会导致计算出的氢氧化钠质量偏大,使所测定氢氧化钠的质量分数偏大.
解答 解:(1)
实验步骤:向待测液中滴加几滴酚酞试液;
实验现象:酚酞试液变红色;
实验结论:待测液中含有氢氧化钠;
(2)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应;
步骤④中判断沉淀物是否洗净的具体操作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,若无白色沉淀生成,说明沉淀物已洗净,反之则没有洗;
(3)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(4)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,沉淀中因含有其他杂质而质量偏大,所测定氢氧化钠的质量分数将偏大.
故答案为:
答案:
探究活动一
(1)取样,滴加几滴无色酚酞试液;溶液变红色(此题其他合理答案也可);
探究活动二
(2)使NaOH完全反应;滴加硝酸银溶液,若无白色沉淀生成,说明沉淀物已洗净,反之则没有洗净.(或其他合理答案)
(3)2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(4)偏大.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
1.下列食物富含淀粉的是( )
| A. | 青菜 | B. | 大米 | C. | 鸡蛋 | D. | 猪肉 |
2.下列除杂方法(括号内为杂质)中正确的是( )
| A. | 二氧化碳(一氧化碳):通入氧气,点燃 | |
| B. | 硝酸铜溶液(硝酸银):加入足量的铜粉,过滤 | |
| C. | 碳酸钙固体(氯化钙):加入足量的水溶解,过滤、洗涤、干燥 | |
| D. | 氢氧化钠溶液(碳酸钠):加入适量的稀盐酸至不再产生气泡 |
5.课外小组的同学上网查阅有关金属资料时,看到镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物.于是产生疑问:产生的气体和白色不溶物是什么物质?在老师的帮助下,他们进行了如图探究.

探究一:产生的无色气体是什么物质?探究实验如表所示.
探究二:白色不溶物N是什么物质?
[查阅资料]
(1)碱石灰是固体氢氧化钠和氧化钙的混合物.
(2)MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
[猜想与假设]
(1)N可能为Mg(OH)2
(2)N可能为MgCO3
(3)N可能是Mg(OH)2和MgCO3的混合物.
实验Ⅲ
①白色固体N,加入足量的稀盐酸,观察到固体N全部溶解,产生无色气泡,则白色固体N一定含有碳酸镁.(填名称)
②称取干燥、纯净的白色不溶物N22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入如图所示装置A和B中.实验后装置A增重1.8g,则白色固体中还含有氢氧化镁(填名称).

探究一:产生的无色气体是什么物质?探究实验如表所示.
| 实验序号 | 实验操作 | 实验现象 | 解释及结论 |
| 实验I | 用砂纸擦去镁条表面氧化膜,将其放入盛有适量饱和碳酸氢钠溶液的试管中 | 迅速反应,产生大量气泡和白色不溶物N | / |
| 实验Ⅱ | 将实M气体点燃,并在火焰上方罩一干、冷的小烧杯 | 气体安静燃烧、产生淡蓝色火焰,烧杯内壁有水雾出现 | 气体M是H2,燃烧的化学方程式为 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
[查阅资料]
(1)碱石灰是固体氢氧化钠和氧化钙的混合物.
(2)MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
[猜想与假设]
(1)N可能为Mg(OH)2
(2)N可能为MgCO3
(3)N可能是Mg(OH)2和MgCO3的混合物.
实验Ⅲ
①白色固体N,加入足量的稀盐酸,观察到固体N全部溶解,产生无色气泡,则白色固体N一定含有碳酸镁.(填名称)
②称取干燥、纯净的白色不溶物N22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入如图所示装置A和B中.实验后装置A增重1.8g,则白色固体中还含有氢氧化镁(填名称).
7.2015年3月9日,太阳能飞机“阳光动力2号”开始环球飞行,并在名古屋和夏威夷之间创下了118小时不间断飞行的记录,下列有关能源和环保的说法错误的是( )
| A. | “阳光动力2号”所用太阳能是绿色环保新能源 | |
| B. | 煤、石油、天然气等化石燃料是不可再生能源 | |
| C. | 煤完全燃烧后就不会对环境造成污染 | |
| D. | 可燃冰具有能量高、燃烧值大等优点,其主要成分是CH4 |

