题目内容
3.如图A装置瓶内气体中可能含有水蒸气、一氧化碳、氢气中的一种或几种,假设气体量足够,反应充分进行,且无有毒气体排出.则
(1)为确定瓶内气体成分,装置最好连接顺序为A→D→B→D→C→E(装置可重复选择).
(2)实验开始后打开E装置的止水夹,发现瓶内的水沿导管流至下方的烧杯中,此时E装置的作用是储气.
(3)为了减少空气中二氧化碳和水蒸气对实验的影响,A装置处的玻璃管应伸入瓶内的c(选填“a”、“b”、“c”)点,理由是有利于排出原有的气体.
分析 (1)根据水能使白色硫酸铜变蓝,二氧化碳能使澄清石灰水变浑浊,氢气还原氧化铜能生成水,一氧化碳还原氧化铜生成二氧化碳考虑本题;
(2)根据装置的特点分析作用;
(3)A装置处的玻璃管应伸入瓶内的深处,有利于气体排出.
解答 解:(1)水能使白色硫酸铜变蓝,二氧化碳能使澄清石灰水变浑浊,氢气还原氧化铜能生成水,一氧化碳还原氧化铜生成二氧化碳.气体从溶液出来会带出水蒸气,故水的鉴定放在第一部;然后利用与氧化铜反应的产物鉴定氢气和一氧化碳,故顺序为:A→D→B→D→C→E;
(2)E装置是利用排水法收集反应后的气体,是储气装置;
(3)A装置处的玻璃管应伸入瓶内的深处,有利于气体排出.
故答案为:(1)D→B→D→C;
(2)储气;
(3)c;有利于排出原有的气体.
点评 本题难度不大,需认真分析装置中各部分的作用.

练习册系列答案
相关题目
18.难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下:
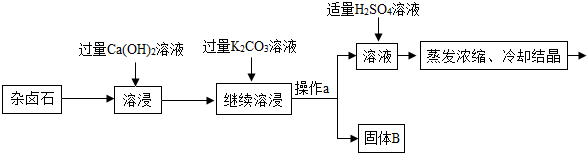
(1)在实验流程中加入过量的Ca(OH)2溶液,目的是除去主要成分中的MgSO4;发生反应的化学方程式是MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4.
(2)操作a的名称是过滤.
(3)请写出固体B的两种主要成分Mg(OH)2、CaCO3(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数来表示浸取率,在相同的时间里,进行了如表实验组:
①上述实验的数据中,温度与K+浸取率的关系是温度越高,K+浸取率越高.
②如表5组实验中,若要获得最佳的K+浸取率,选择的反应条件是60℃和Ca(OH)23g.

(1)在实验流程中加入过量的Ca(OH)2溶液,目的是除去主要成分中的MgSO4;发生反应的化学方程式是MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4.
(2)操作a的名称是过滤.
(3)请写出固体B的两种主要成分Mg(OH)2、CaCO3(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数来表示浸取率,在相同的时间里,进行了如表实验组:
| 实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
| a | 25 | 2.5 | 72.4 |
| b | 40 | 2.5 | 86.55 |
| c | 40 | 3 | 90.02 |
| d | 60 | 3 | 91.98 |
| e | 60 | 4 | 91.45 |
②如表5组实验中,若要获得最佳的K+浸取率,选择的反应条件是60℃和Ca(OH)23g.
15.要证明稀硫酸中含有盐酸所需药品正确的滴加顺序是( )
| A. | 先滴加AgNO3溶液再滴加BaCl2溶液 | |
| B. | 先滴加BaCl2 溶液再滴加AgNO3溶液 | |
| C. | 先滴加Ba(NO3)2 溶液再滴加AgNO3溶液 | |
| D. | 先滴加AgNO3 溶液再滴加Ba(NO3)2溶液 |
12.下列各组物质在溶液中能大量共存且形成无色溶液的是( )
| A. | K2CO3 HCl Na2SO4 | B. | KNO3 HCl NaCl | ||
| C. | H2SO4 FeCl3 KOH | D. | CuSO4 HCl NaNO3 |


 在宏观、微观和符号之间建立联系是化学科学的特点.
在宏观、微观和符号之间建立联系是化学科学的特点.