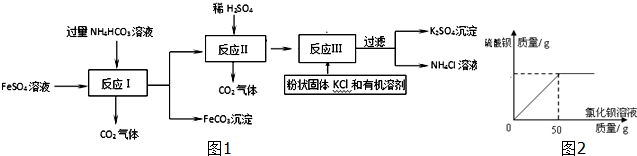
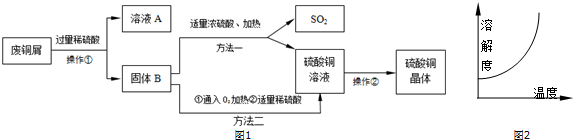
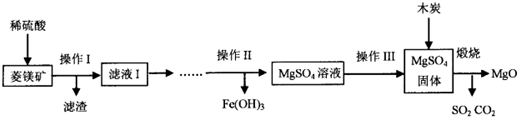
题目内容
14.以白云石(主要成分化学式为MgCO3•CaCO3)为原料制备氢氧化镁的工艺流程如图1: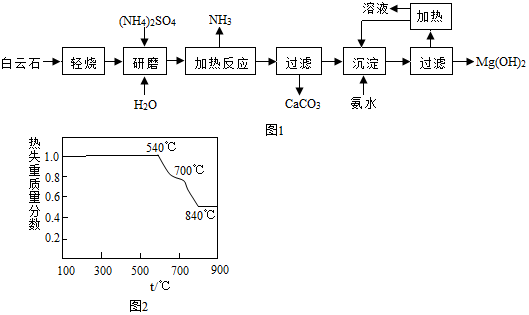
(1)白云石属于混合物(选填“混合”“纯净”),白云石“轻烧”过程中只发生了碳酸镁的分解,写出碳酸镁分解反应的化学方程式MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑;依据如图2判断“轻烧”温度应不超过700℃.
(2)流程图中“加热反应”是指硫酸铵与氧化镁在加热条件下反应生成一种盐、氨气和水,其化学方程式为
(NH4)2SO4+MgO$\frac{\underline{\;\;△\;\;}}{\;}$MgSO4+2NH3↑+H2O.
(3)该工艺中可以循环使用的物质是NH3、(NH4)2SO4等.
(4)传统制备氢氧化镁的工艺是将白云石高温下分解为氧化镁和氧化钙后再提取,而本工艺流程采用轻烧白云石的方法,其优点是减少能源消耗、便于CaCO3分离.
分析 根据物质的性质、化学方程式的书写方法、温度的控制、以及流程的优点进行分析解答即可.
解答 解:(1)白云石属于混合物,碳酸镁分解生成氧化镁和二氧化碳,根据图2可以看出温度不能超过700℃,故填:混合,MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑,700℃;
(2)硫酸铵与氧化镁在加热条件下反应生成硫酸镁、氨气和水,故填:(NH4)2SO4+MgO$\frac{\underline{\;\;△\;\;}}{\;}$MgSO4+2 NH3↑+H2O;
(3)根据流程图可以看出,氨气和硫酸铵能循环利用,故填:NH3;
(4)采用轻烧白云石的方法制备氢氧化镁,能减少能源消耗、便于CaCO3分离,故填:减少能源消耗,便于CaCO3分离.
点评 本题考查的是常见的物质的制备的知识,完成此题,可以依据物质的性质结合流程图进行.

练习册系列答案
相关题目
20.下列做法或说法中错误的是( )
| A. | 火场逃生时在有烟雾的地方应匍匐前进 | |
| B. | 为了防止水污染,农业上要合理使用化肥、农药 | |
| C. | 回收废旧电池,即可节约金属资源又可减少环境污染 | |
| D. | 人体缺锌会引起生长发育缓慢,因此锌元素的摄入量越多越好 |
4.空气、水是重要的自然资源,下列空气、水的认识正确的是( )
| A. | 过滤、煮沸、蒸馏操作中煮沸的净水程度最高 | |
| B. | 水体有自净能力,未经处理的生活污水可随意排放 | |
| C. | 空气中含量最多的单质是氧气 | |
| D. | 空气中的二氧化碳是植物进行光合作用必需的物质 |
 量筒是用来取用一定量液体药品的仪器,使用时,量筒必须放在水平桌面上,视线要跟凹液面的最低处保持水平,如图中量筒内液体的读数是44mL.
量筒是用来取用一定量液体药品的仪器,使用时,量筒必须放在水平桌面上,视线要跟凹液面的最低处保持水平,如图中量筒内液体的读数是44mL.