题目内容
某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠和一瓶未标浓度的稀盐酸。为测定氢氧化钠的变质情况和稀盐酸的浓度,他们取9.3g变质的氢氧化钠样品于锥形瓶中,加人50g水,充分溶解,再向锥形瓶中滴加未知浓度的稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如下图所示。
求:(1)9.3g样品中碳酸钠的质量。
(2)未知浓度的稀盐酸的溶质质量分数。
【答案】解:由图中的质量关系图可知:
产生CO2的质量是(9.3g+50g+50g)-107.1g=2.2g
设9.3g样品中Na2CO3的质量为x,与Na2CO3反应的HCl的质量为y,与NaOH反应的HCl的质量为
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 73 44
X y 2.2、
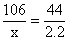
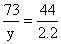
X=5.3g y=3.65g
HCl + NaOH== NaCl + H2O
36.5 40
9.3g-5.3g z
Z=3.65g
稀盐酸的质量分数=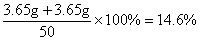
答:9.3g样品中碳酸钠的质量为5.3g,稀盐酸是质量分数为14.6%
【解析】由图中的质量关系图可知:产生CO2的质量是(9.3g+50g+50g)-107.1g=2.2g
设9.3g样品中Na2CO3的质量为x,与Na2CO3反应的HCl的质量为y,与NaOH反应的HCl的质量为
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 73 44
X y 2.2、
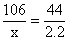
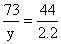
X=5.3g y=3.65g
HCl + NaOH== NaCl + H2O
36.5 40
9.3g-5.3g z
Z=3.65g
稀盐酸的质量分数=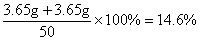
答:9.3g样品中碳酸钠的质量为5.3g,稀盐酸是质量分数为14.6%

小英同学为了侧定某地区石灰石样品中碳酸钙的质量分数,取该样品15g,现将75m1的稀盐酸分三次加人石灰石样品中,每次充分反应后测得生成气体的质量,实验数据如下表:
| 实验 | 第一次 | 第二次 | 第三次 |
| 加人稀盐酸的量/ml | 25 | 25 | 25 |
| 生成气体的质量/g | 2.2 | m | 1.1 |
试求:
(1)m的值是 g。
(2)求该样品中碳酸钙的质量分数(保留一位小数)?
欲测定某锌-铜合金中铜的质量分数,进行如下实验:取合金样品10g放入烧杯中,将60g稀硫酸分三次加入,充分反应后,测得生成气体的质量如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 加入稀硫酸质量/g | 20 | 20 | 20 |
| 生成气体质量/g | 0.08 | m | 0.04 |
请回答下列问题并计算:
(1)第二次实验时生成气体质量m= g;
(2)计算该合金样品中铜的质量分数。
 它气体,吸湿速度极快。分子筛干燥剂吸水前后的变化属于______变化(填“物理”或“化学”)。
它气体,吸湿速度极快。分子筛干燥剂吸水前后的变化属于______变化(填“物理”或“化学”)。 硫酸的用途极广,常用于生产化肥、冶炼金属、农药、制药等。
硫酸的用途极广,常用于生产化肥、冶炼金属、农药、制药等。 沾到皮肤上的处理方法是 。
沾到皮肤上的处理方法是 。