题目内容
某混合物中含有碳酸钙和氯化钙,取该混合物6g,向其中加入一定质量的质量分数为10%的稀盐酸,恰好完全反应,产生2.2g气体。(假设气体全部逸出)。
计算:
(1) 所取混合物中碳酸钙的质量。
(2) 所加稀盐酸的质量
(3) 反应后所得溶液中的质量分数(计算结果精确到0.1%)
【答案】解:设所取混合物中碳酸钙的质量为x;所加稀盐酸中溶质的质量为y;生成的氯化钙的质量为z
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
X y z 2.2g

X=5g y=3.65g z=5.55g
(2)所加稀盐酸的质量为:3.65g÷10%=36.5g
(3)反应后所得溶液中溶质的质量为:(6g-5g)+5.55g=6.55g
反应后所得溶液的质量为:6g+36.5g-2.2g=40.3g
反应后所得溶液的溶质质量分数为: =16.3%
=16.3%
答:(1)所取混合物中碳酸钙的质量为5g;(2)所加稀盐酸的质量为36.5g;(3)
反应后所得溶液中的质量分数16.3%。
【解析】经分析可知2.2g气体为产生的二氧化碳的质量,根据化学方程式可以求出所取混合物中碳酸钙的质量为5g,反应的稀盐酸的溶质的质量为3.65g,生成的氯化钙的质量为5.55g,根据稀盐酸的溶质质量分数可以求出所加稀盐酸的质量为36.5g,由于所取混合物中含有氯化钙,所以反应后溶液的质量为(6g-5g)+5.55g=6.55g;反应后溶液的质量为6g+36.5g-2.2g=40.3g,根据溶质的质量分数计算公式可以求出所得溶液的溶质质量分数为16.3%。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 8.5 | 7 | 6.6 | 6.6 |
(1)铜镁合金中铜的质量。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程)
 2MgO + C,该反应的基本反应类型是 ,氧化物是 。该反应的实验现象是 。
2MgO + C,该反应的基本反应类型是 ,氧化物是 。该反应的实验现象是 。
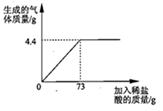 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图 是多少?(计算结果保留一位小数,下同)
是多少?(计算结果保留一位小数,下同)