题目内容
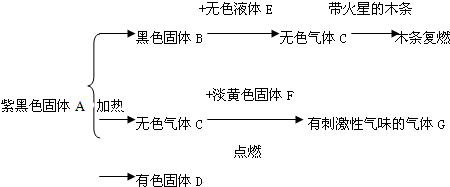
18.坐落于扬州宝应的江苏宝胜集团是一家以生产电缆类产品为主的国家大型企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法.甲同学根据已学知识,提出了一套回收方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应
(方程式为:2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O),于是他提出了另一套方案:

(1)甲方案的①②③三个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
①2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
②CuO+H2SO4═CuSO4+H2O;
③Fe+CuSO4═FeSO4+Cu.
(2)从环保角度对两套方案的不同部分进行比较,你认为乙(填“甲”或“乙”)的方案更合理.理由是:甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾.
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑.你认为丙这么说的道理是:“确保CuSO4用完”或“将Cu完全置换出来”(合理即可).
(4)丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该怎么处理呢?”.请提出你的想法:将所得铜粉酸洗后再洗涤、干燥或过滤前在加适量的酸以除去剩余的铁粉.
(5)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益.请写出使“绿矾”结晶的两种可能方法:蒸发、降温(“绿矾”溶解度随温度升高而增大).如果直接排放掉滤液,不仅造成了浪费,还会水污染或环境污染.
(6)若上述方案所用的稀硫酸溶质质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸4900g,需水3060mL(水的密度为1.0g/mL).在实验室中稀释浓硫酸时,是如何操作的:将浓硫酸沿玻璃棒加入水中.
(7)根据乙同学查出的方程式(2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$ 2CuSO4+2H2O)计算:如果1000mL98%的浓硫酸(密度为1.84g/mL)稀释后全部参加了反应(假设硫酸不和碎电缆皮、其他杂质反应),所能处理的废料中含纯铜多少克?(请写出计算过程,结果精确到0.1克.)
分析 “从含铜废料中回收铜”符合绿色化学的理念,再回收利用中,设计了两套方案,处理有关问题,并进行评价.甲方案中:发生的有关化学方程式为:①2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;②CuO+H2SO4═CuSO4+H2O;③Fe+CuSO4═FeSO4+Cu.但“灼烧”会产生污染空气的气体、粉尘、烟雾,所以不如乙方案更合理;然后设计提取的有关问题;最后考查学生的计算能力及体验回收成果,增强成就感.
解答 解:(1)由题意,甲方案中:发生的有关化学方程式为:①2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;②CuO+H2SO4═CuSO4+H2O;③Fe+CuSO4═FeSO4+Cu;
(2)从环保的角度,乙方案更合理,甲方案的“灼烧”会产生污染空气的气体、粉尘、烟雾;
(3)加入略过量的铁屑的目的是“确保CuSO4用完”或“将Cu完全置换出来”;
(4)多余的铁粉可以利用铁和酸反应除去;
(5)蒸发、降温都能使“绿矾”结晶出来,直接排放掉滤液,不仅造成了浪费,还会造成环境污染或水污染;
(6)设稀硫酸的质量为x,则36.8%x=1000mL×1.84g/mL×98%,得x=4900g;需要水的体积:(4900g-1000mL×1.84g/mL)÷1.0g/mL=3060mL;
稀释浓硫酸的方法是:将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌;
(7)由题意,列式计算即可.
故答案为:(1)①2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;②CuO+H2SO4═CuSO4+H2O;③Fe+CuSO4═FeSO4+Cu;
(2)乙;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾;
(3)“确保CuSO4用完”或“将Cu完全置换出来”(合理即可);
(4)将所得铜粉酸洗后再洗涤、干燥或过滤前在加适量的酸以除去剩余的铁粉;
(5)蒸发、降温;水污染或环境污染;
(6)4900,3060;将浓硫酸沿玻璃棒加入水中;
(7)解:设所能处理的废料中纯铜质量为x.
2Cu+2H2SO4+O2?2CuSO4+2H2O
2×64 2×98
x 1000mL×1.84g/mL×98%
$\frac{2×64}{x}$=$\frac{2×98}{1000mL×1.84g/mL×98%}$
x=1177.6g
答:所能处理的废料中含纯铜1177.6克.
点评 本题探讨了“从含铜废料中回收铜”的有关问题,设计了不同的方案,并进行评价,考察了考生的思考、探讨、评价等诸多能力.

| A. | 用带火星的木条 | B. | 分别称取各自的质量 | ||
| C. | 倒入澄清的石灰水 | D. | 用燃着的木条 |
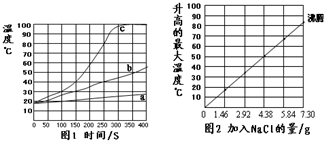 无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响).
无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响). 某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质
某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质