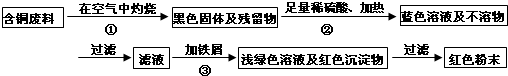
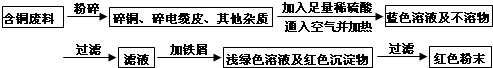
题目内容
3.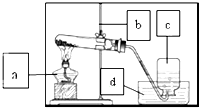 某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质
某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质(1)写出用该方法制取氧气的化学反应符号表达式:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)请指出如图中所用仪器的名称:
a酒精灯;b铁架台;c集气瓶;
(3)做该实验时在试管口放一团棉花的目的是:防止高锰酸钾颗粒沿着导管进入集气瓶.
(4)试管口略向下倾斜的原因是防止冷凝水倒流引起试管的炸裂.
(5)用这种方法收集氧气时,当气泡连续均匀冒出时再开始收集,收集满氧气后,应用玻璃片盖住集气瓶口,并且应正(填“正放”或“倒放”)在桌上.
(6)他们用这种方法收集了两瓶气体,在先收集的一瓶插入带火星的木条,只看到火星亮了一些,插入后收集的一瓶木条则能复燃.导致这个现象的可能的原因是(写出操作上的原因):没有等到气泡连续均匀冒出时就开始收集.
(7)实验室用无水醋酸钠固体和碱石灰固体反应制甲烷的发生装置与上面装置相同,其原因是:1、反应物的状态都为固态2、反应条件都是加热.甲烷难溶于水,且密度比空气小,因此可用排水法或向下排空气法收集.
分析 (1)根据高锰酸钾制取氧气的反应原理书写化学反应方程式;
(2)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(3)根据高锰酸钾制取氧气的注意事项考虑;
(4)根据加热试管的注意事项分析;
(5)根据排水收集气体的注意事项及氧气的密度比空气密度大进行解答;
(6)根据收集气体的注意事项进行解答;
(7)根据反应物的状态和反应条件选择发生装置,根据气体的溶解性和密度选择收集方法.
解答 解:(1)用加热高锰酸钾的方法制取氧气时,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,故反应的化学方程式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)通过分析题中所指仪器的作用可知:a是酒精灯,b是铁架台,c是集气瓶;故填:酒精灯;铁架台;集气瓶;
(3)实验室用高锰酸钾制取氧气,试管口需要放一团棉花的原因是防止高锰酸钾颗粒沿着导管进入集气瓶;故填:防止高锰酸钾颗粒沿着导管进入集气瓶;
(4)加热试管时试管口略向下倾斜,目的是防止冷凝水倒流引起试管的炸裂;故填:防止冷凝水倒流引起试管的炸裂;
(5)用排水法设计引起时要等到气泡连续均匀冒出时进行收集,防止收集的氧气不纯;氧气的密度比空气密度大,因此正放在桌子上;故填:连续均匀冒出时;正;
(6)由于试管内有大量的空气,因此应等到气泡均匀冒出时才能收集氧气,否则就会使收集到的氧气不纯.所以,导致在第一瓶中带火星的木条亮一下的原因是:没有等到气泡连续均匀冒出时就开始收集;故填:没有等到气泡连续均匀冒出时就开始收集;
(7)实验室用无水醋酸钠和碱石灰反应制甲烷的发生装置与制氧气的发生装置相同的原因是:反应物的状态都为固态;反应条件都是加热;甲烷的密度比空气小,可以用向下排空气法收集,不溶于水,可以用排水法收集.
故答案为:反应物的状态都为固态;反应条件都是加热;排水;向下排空气.
点评 气体的制取是教材上最主要的实验之一,在考查中占有重要地位,要熟练掌握气体制取的仪器的使用、装置的选择、原理及方程式、步骤、注意事项、装置评价,装置改进等知识点,并能灵活应用.

| A. | 离子是带电荷的原子或原子团,所以带电荷的微粒一定是离子 | |
| B. | 稀释浓硫酸时,可将水沿器壁慢慢注入浓硫酸里,并不断搅拌 | |
| C. | 能生成盐和水的反应一定属于中和反应 | |
| D. | 一氧化碳和氢气都能夺取氧化铜中的氧,它们都具有还原性 |
 近日,清华学子不畏网络舆论的压力,捍卫了“PX”低毒的科学真相.PX:无色透明液体,具有芳香气味,能与乙醇等有机溶剂混溶,可燃,低毒,毒性略高于乙醇,其蒸气与空气可形成爆炸性混合物.如图是“PX”的结构模型,下列有关“PX”的说法不正确的是( )
近日,清华学子不畏网络舆论的压力,捍卫了“PX”低毒的科学真相.PX:无色透明液体,具有芳香气味,能与乙醇等有机溶剂混溶,可燃,低毒,毒性略高于乙醇,其蒸气与空气可形成爆炸性混合物.如图是“PX”的结构模型,下列有关“PX”的说法不正确的是( )| A. | 一个“PX”分子中有18个原子核 | |
| B. | “PX”可燃,具有芳香气味,低毒都属于它的化学性质 | |
| C. | “PX”中C、H两种元素的质量比为4:5 | |
| D. | “PX”的化学式为C8H10 |
| A. | 燃烧生成水和二氧化碳 | B. | 白色 | ||
| C. | 不溶于水 | D. | 能燃烧 |
| A. | MN | B. | al | C. | Fe | D. | i |
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜.铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液
【预 测】三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
【实验过程】取大小相同的三种金属薄片,用砂纸打磨光亮.
| 实验一 | 实验二 | 实验三 | |
实验 方案 | 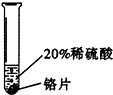 |  |  |
| 实验 现象 | 铬片表面产生气泡缓慢,溶液变蓝色. | 无现象 | 铝片表面产生气泡较快. |
| 结论 | 铬能和稀硫酸发生反应,反应速率较慢. | 铜不与稀硫酸反应 | |
| 三种金属在金属活动性顺序中的相对位置关系是Al Cr Cu(或“②”) | |||
(2)用砂纸打磨金属片的目的是除去金属表面氧化物(或污物).
(3)实验一所发生反应的化学方程式是Cr+H2SO4═CrSO4+H2↑.
(4)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是无法比较铬和铝的金属活动性强弱.
(5)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是Al、CrSO4溶液、Cu.