题目内容
16.图1是氢气在氯气中燃烧生成氯化氢的微观模拟图,请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)从物质分类角度来看,氢气属于纯净物中的单质;
(3)此变化前后没有发生改变的微观粒子有氢原子和氯原子.
(4 )图2是元素周期表中的一格.氖的相对原子质量为20.18;该元素在元素周期表中位于第二周期的最右边(填“最左边”、“中间”或“最右边”).
分析 (1)根据质量守恒定律反应前后原子的种类及数目不变将将B图补充完整;
(2)根据氢气的组成分析;
(3)根据微粒的变化分析在化学变化中发生变化的微粒;
(4)根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析判断即可.
解答 解:(1)由质量守恒定律反应前后原子的种类及数目不变以及氢气和氯气反应生成了氯化氢可知,在B图中补充两个氯化氢分子,如图:
(2)氢气是由同种元素组成的纯净物属于单质;
(3)由图示中微粒的变化可以得出,在化学变化中,没有发生改变的微观粒子有氢原子和氯原子;
(4)根据元素周期表中一格的意义可知,汉字下面的数字表示相对原子质量,氖的相对原子质量为20.18;该元素在元素周期表中位于第二周期的最右边.
故答:故答为:(1)
(2)单质; (3)氢原子和氯原子;(4)20.18,最右边.
点评 本题难度不大,考查学生灵活运用元素周期表中元素的信息和原子结构示意图的意义进行分析解题的能力.

练习册系列答案
相关题目
6.下列有关水和溶液的说法正确的是( )
| A. | 自然界中的水都属于化合物,溶液都属于混合物 | |
| B. | 硬水和软水都属于溶液,生活中可通过加热的方法将硬水软化 | |
| C. | 溶液中的溶剂不一定是水,硫酸铜溶液中溶剂是硫酸 | |
| D. | 某物质在100g溶剂里达到饱和状态时所溶解的质量就是该物质的溶解度 |
7.铁铝是生活中常用的金属,下列生活中的一些做法,正确的是( )
| A. | 铁制品的表面生锈后不必立即清除,理由是铁锈能阻止内部的铁继续生锈 | |
| B. | 铝锅用久了表面会有些污垢,最科学的除去污垢的方法是用钢丝球用力擦洗 | |
| C. | 铝制品具有较强的耐腐蚀性,其原因是铝的化学性质不活泼,盛醋最好选择铝制容器 | |
| D. | “暖宝宝”中有铁粉、氯化钠和水等,发热原理是铁粉氧化放热,“暖宝宝”应密封保存 |
4.测定硫酸铜晶体(CuSO4•nH2O)里的结晶水含量,实验步骤为:①研磨 ②称量空坩埚(容器)和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③-⑤的操作,反复三次,到质量不再变化为止 ⑦根据所得的实验数据计算硫酸铜结晶水的含量.请回答下列问题:
(1)现有坩埚、坩埚钳、泥三角、三脚架、石棉网、玻璃棒、药匙、干燥器、火柴、酒精灯、硫酸铜晶体样品等实验仪器和药品,进行该实验时,还缺少的实验仪器是研钵、托盘天平.
(2)实验步骤⑥的目的是使结晶水完全失去,从而使结果更准确.
(3)如果实验得到以下数据:
写出该样品中结晶水含量(a%)的计算公式a%=$\frac{W_{2}-W_{3}}{W_{2}-W_{1}}$×100%(用W1、W2、W3表示).
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有DF(填字母).
A.加热前称量时坩埚未完全干燥 B.加热时间过长,晶体部分变黑
C.加热过程中有少量晶体溅出 D.粉末未完全变白就称量
E.坩埚里有不易分解的杂质 F.放在空气中冷却称量
(5)波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,当中的Cu2+有剧毒,如误食波尔多液,应大量食用鸡蛋清.波尔多液常用来杀菌,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主要物质是蛋白质(填一种有机物名称).
(1)现有坩埚、坩埚钳、泥三角、三脚架、石棉网、玻璃棒、药匙、干燥器、火柴、酒精灯、硫酸铜晶体样品等实验仪器和药品,进行该实验时,还缺少的实验仪器是研钵、托盘天平.
(2)实验步骤⑥的目的是使结晶水完全失去,从而使结果更准确.
(3)如果实验得到以下数据:
| 加热前质量(g) | 加热后质量(g) | |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有DF(填字母).
A.加热前称量时坩埚未完全干燥 B.加热时间过长,晶体部分变黑
C.加热过程中有少量晶体溅出 D.粉末未完全变白就称量
E.坩埚里有不易分解的杂质 F.放在空气中冷却称量
(5)波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,当中的Cu2+有剧毒,如误食波尔多液,应大量食用鸡蛋清.波尔多液常用来杀菌,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主要物质是蛋白质(填一种有机物名称).
11.下列实验操作符合规范的是( )
| A. |  倾倒液体 | B. |  量取8mL液体 | ||
| C. |  氧气验满 | D. |  铁丝在氧气中燃烧 |
8.下列实验现象的描述正确的是( )
| A. | 打开盛有浓盐酸的试剂瓶瓶塞,瓶口有白烟出现 | |
| B. | 硫在空气中燃烧,发出明亮的蓝紫色火焰,生成无色无味的气体 | |
| C. | 向含有酚酞的氢氧化钠溶液中滴加稀盐酸,溶液最终变成无色 | |
| D. | 铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 |
5.如图为某反应的微观示意图,下列说法中不正确的是( )
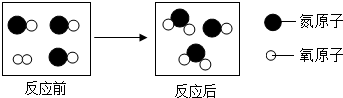

| A. | 反应前后分子数目改变 | B. | 反应前后元素种类不变 | ||
| C. | 反应前后的质量比为45:16 | D. | 反应前后氮元素化合价发生改变 |
6.为了除去下列物质中的杂质(括号内是杂质),下列操作方法中,正确的是( )
| 选项 | 物质 | 操作方法 |
| A | Fe (Fe2O3) | 加入过量稀盐酸,充分反应后过滤 |
| B | CaO粉末(CaCO3粉末) | 加足量的水,充分搅拌后过滤 |
| C | CuSO4 (H2SO4) | 加入足量的NaOH溶液,充分反应后过滤 |
| D | NaOH溶液(Na2CO3) | 加入适量Ca(OH)2溶液,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |