题目内容
8.下列实验现象的描述正确的是( )| A. | 打开盛有浓盐酸的试剂瓶瓶塞,瓶口有白烟出现 | |
| B. | 硫在空气中燃烧,发出明亮的蓝紫色火焰,生成无色无味的气体 | |
| C. | 向含有酚酞的氢氧化钠溶液中滴加稀盐酸,溶液最终变成无色 | |
| D. | 铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 |
分析 A、根据浓盐酸具有挥发性,进行分析判断.
B、根据硫在空气中燃烧的现象进行分析判断.
C、根据中和反应的现象进行分析判断.
D、根据铁丝在空气中燃烧的现象进行分析判断.
解答 解:A、浓盐酸具有挥发性,打开盛有浓盐酸的试剂瓶瓶塞,瓶口有白雾出现,故选项说法错误.
B、硫在空气中燃烧,产生淡蓝色火焰,产生一种具有刺激性气味的气体,故选项说法错误.
C、向含有酚酞的氢氧化钠溶液(显红色)中滴加稀盐酸,氢氧化钠与稀盐酸反应生成氯化钠和水,至恰好完全反应,溶液显中性;继续滴加稀盐酸,溶液显酸性,溶液最终变成无色,故选项说法正确.
D、铁丝在空气中只能烧至发红,不会剧烈燃烧,火星四射,故选项说法错误.
故选:C.
点评 本题难度不大,掌握中和反应、浓盐酸具有挥发性、常见物质燃烧的现象即可正确解答,在描述实验现象时,需要注意烟和雾的区别.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
18. 化学探究课上,老师拿来一瓶标签有破损的试剂瓶,里面盛有一种无色溶液(如图).
化学探究课上,老师拿来一瓶标签有破损的试剂瓶,里面盛有一种无色溶液(如图).
【提出问题】这瓶试剂可能是什么溶液呢?
【做出猜想】第一组:可能是CaO溶液;
第二组:可能是CaCO3溶液;
第三组:可能是CaCl2溶液;
第四组:可能是Ca(OH)2溶液;
第五组:可能是Ca(NO3)2溶液.
【交流讨论】讨论后,大家一致认为第一组和第二组的猜想不正确,
第一组猜想不正确的原因是氧化钙和水反应生成氢氧化钙,无法形成溶液,
第二组猜想不正确的原因是碳酸钙不溶于水,无法形成溶液.
【知识梳理】CaCl2溶液和Ca(NO3)2溶液均为中性,Ca(OH)2溶液为碱性.
【实验探究】
③小美同学认为,X可以是Na2CO3溶液,而小园同学认为X是Na2CO3溶液不能证明第三组猜想成立,理由是(用化学方程式解释)Na2CO3+Ca(NO3)2═2NaNO3+CaCO3↓.
④经大家讨论,一致认为,X应该是AgNO3(填化学式)溶液.
【得出结论】第三组猜想成立,此无色溶液为CaCl2溶液.
 化学探究课上,老师拿来一瓶标签有破损的试剂瓶,里面盛有一种无色溶液(如图).
化学探究课上,老师拿来一瓶标签有破损的试剂瓶,里面盛有一种无色溶液(如图).【提出问题】这瓶试剂可能是什么溶液呢?
【做出猜想】第一组:可能是CaO溶液;
第二组:可能是CaCO3溶液;
第三组:可能是CaCl2溶液;
第四组:可能是Ca(OH)2溶液;
第五组:可能是Ca(NO3)2溶液.
【交流讨论】讨论后,大家一致认为第一组和第二组的猜想不正确,
第一组猜想不正确的原因是氧化钙和水反应生成氢氧化钙,无法形成溶液,
第二组猜想不正确的原因是碳酸钙不溶于水,无法形成溶液.
【知识梳理】CaCl2溶液和Ca(NO3)2溶液均为中性,Ca(OH)2溶液为碱性.
【实验探究】
| 实验方案 | 滴加酚酞溶液 | 通入 ②二氧化碳气体 | 滴加X溶液 |
| 实验操作 |  |  |  |
| 实验现象 | ①溶液没有变红 | 未出现浑浊 | 产生白色沉 |
| 实验结论 | 第四组猜想不成立 | 第四组猜想不成立 | 第三组猜想成立 |
④经大家讨论,一致认为,X应该是AgNO3(填化学式)溶液.
【得出结论】第三组猜想成立,此无色溶液为CaCl2溶液.
3.“保护环境”是我国的基本国策,下列做法不应该提倡的是( )
| A. | 采取低碳、节俭的生活方式 | |
| B. | 按照规定对生活废弃物进行分类放置 | |
| C. | 深入农村和社区宣传环保知识 | |
| D. | 经常使用一次性筷子、纸杯、塑料袋等 |
13.下列四个图象能正确反映实验变化关系的是( )
| A. |  常温下,向等质量、等质量分数的稀盐酸中分别加入锌粉和铁粉 | |
| B. |  敞口放置于空气中的浓硫酸或稀盐酸 | |
| C. |  加热KNO3、Ca(OH)2的饱和溶液(不考虑溶剂的蒸发) | |
| D. |  少量的碳在密闭的集气瓶中与氧气完全燃烧 |
18.“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺,同学们查阅相关资料并进行模拟实验.
【查阅资料】
①生产原理:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(固体)↓+NH4Cl
②主要生产流程如图所示:

③氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
【理论分析】
(1)依据资料①可知相同条件下,NaHCO3的溶解度NH4Cl的溶解度<(填“>”或“<”).
(2)NaHCO3受热分解制得纯碱及两种常见的氧化物,该反应的化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
【模拟实验】验证侯氏制碱法能获得纯碱
【实验反思】同学们认为步骤3的结论存在不足.依据题中信息,设计实验确定步骤2加热后得到的固体成分,其方案是将生成的气体通入澄清的石灰水,观察到澄清的石灰水变浑浊,证明步骤2加热后得到的是碳酸氢钠.
【查阅资料】
①生产原理:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(固体)↓+NH4Cl
②主要生产流程如图所示:

③氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
【理论分析】
(1)依据资料①可知相同条件下,NaHCO3的溶解度NH4Cl的溶解度<(填“>”或“<”).
(2)NaHCO3受热分解制得纯碱及两种常见的氧化物,该反应的化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
【模拟实验】验证侯氏制碱法能获得纯碱
| 步骤 | 蘸有稀硫酸 实验装置 | 实验操作及现象 | 解释与结论 |
| 1 |  | 从a管通入NH3,一段时间后,从b管通入CO2,溶液中有固体析出 | (1)蘸有稀硫酸的棉花的作用是 (2)通NH3的a管若伸到液面下,会造成的后果是 |
| 2 |  | 加热,导管口有气泡,澄清石灰水变浑浊 | 步骤1析出的固体是碳酸氢钠 |
| 3 |  | 滴加足量稀盐酸,有气泡产生,固体逐渐消失 | 步骤2加热后得到的固体是纯碱 |

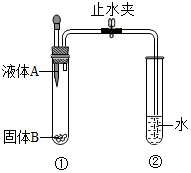 如图所示装置进行实验:当打开止水夹,挤压滴管将液体A滴入试管①时,观察到试管②有气泡产生.
如图所示装置进行实验:当打开止水夹,挤压滴管将液体A滴入试管①时,观察到试管②有气泡产生.