题目内容
14.锌及其氧化物(ZnO,白色,难溶于水,溶于强酸)具有广泛的应用.(一)锌的广泛应用
(1)锌被称之为“生命元素”.儿童、青少年如果缺锌严重,将会导致食欲不振和智力发育不良.经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指B.
A.单质 B.元素 C.原子 D.分子
(2)锌与铜熔合可形成“黄铜”,它属于A(选填序号).
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:
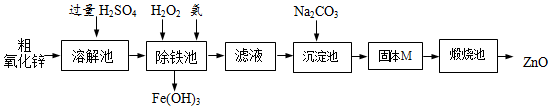
【查阅资料】一些阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的pH见表.
| 沉淀物 | Fe(OH)3 | Zn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 6.2 | 6.3 |
| 完全沉淀pH | 3.2 | 8.0 | 9.7 |
(3)“溶解”前将粗氧化锌粉碎成细颗粒,目的是增大接触面积,加快反应速率.
(4)写出在粗ZnO样品中加硫酸发生反应的化学方程式ZnO+H2SO4═ZnSO4+H2O(选写一个).
(5)“溶解”后得到的酸性溶液中含有ZnSO4、H2SO4、FeSO4.除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为3.2~6.2.
【组成测定】固体B的组成会影响制得的ZnO的活性.为确定aZnCO3•bZn(OH)2•cH2O的组成,进行如下实验(假设每步反应、吸收均完全):
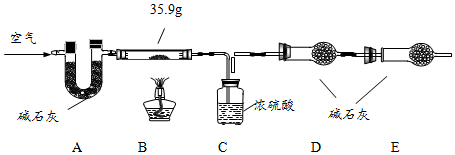
【查阅资料】aZnCO3•bZn(OH)2•cH2O受热分解生成ZnO、H2O、CO2三种产物.
(6)写出装置B中发生反应的化学方程式aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+aCO2↑+(b+c)H2O .
现称取35.9g aZnCO3•bZn(OH)2•cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2g和4.4g.
【实验分析及数据处理】
(7)装置A的作用是除去空气中二氧化碳和水.
(8)根据上述数据,则生成ZnO的质量为24.3 g;a:b:c=1:2:2.
(9)若没有E装置,则测得的a值偏大(填“偏大”、“偏小”或“不变”).
分析 (1)经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指锌元素;
(2)材料包括金属材料、无机非金属材料、合成材料、复合材料等;
(3)反应物接触面积越大,反应速率越快;
(4)氧化锌和稀硫酸反应生成硫酸锌和水,氧化亚铁和稀硫酸反应生成硫酸亚铁和水;
(5)根据提供的信息可以判断相关方面的问题;
(6)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
(7)装置A的作用是吸收空气中的水蒸气和二氧化碳;
(8)根据上述数据,可以进行相关方面的计算;
(9)若没有E装置,空气中的水蒸气和二氧化碳会进入D装置中.
解答 解:(1)经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指锌元素.
故选:B.
(2)锌与铜熔合可形成“黄铜”,黄铜是合金,属于金属材料.
故选:A.
(3)“溶解”前将粗氧化锌粉碎成细颗粒,目的是增大接触面积,加快反应速率.
故填:增大接触面积,加快反应速率.
(4)氧化锌和稀硫酸反应生成硫酸锌和水,氧化亚铁和稀硫酸反应生成硫酸亚铁和水,反应的化学方程式为:ZnO+H2SO4═ZnSO4+H2O,FeO+H2SO4═FeSO4+H2O.
故填:ZnO+H2SO4═ZnSO4+H2O.
(5)“溶解”后得到的酸性溶液中含有ZnSO4、H2SO4、FeSO4.除铁池中加入适量H2O2,使Fe2+转化为Fe3+;
为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为3.2~6.2.
故填:H2SO4;3.2~6.2.
(6)装置B中发生反应的化学方程式为:aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+aCO2↑+(b+c)H2O.
故填:aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+aCO2↑+(b+c)H2O.
(7)装置A的作用是除去空气中二氧化碳和水.
故填:除去空气中二氧化碳和水.
(8)根据上述数据,则生成ZnO的质量为:35.9g-7.2g-4.4g=24.3g;
aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+aCO2↑+(b+c)H2O,
81(a+b) 44a 18(b+c)
24.3g 4.4g 7.2g
$\frac{81(a+b)}{24.3g}$=$\frac{44a}{4.4g}$=$\frac{18(b+c)}{7.2g}$,
a:b:c=1:2:2,
故填:24.3; 1:2:2.
(9)若没有E装置,空气中的水蒸气和二氧化碳会进入D装置中,会导致计算的二氧化碳质量偏大,从而导致测得的a值偏大.
故填:偏大.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 名称:碳酸钾 | B. | 类别:盐 | C. | 焰色反应:黄色 | D. | 用途:可作钾肥 |
| A. | 冰、水 | B. | 氧气、臭氧 | C. | 金刚石、石墨 | D. | 红磷、白磷 |
| A. | 3AB2+B2=2C | B. | 2AB2+2B 2=2C | C. | 4AB 2+B 2=2C | D. | AB 2+2B 2=2C |
| A. | 从构成角度看,氧气是由氧气分子构成的 | |
| B. | 从物理性质角度看,氧气易溶于水,所以鱼虾能生活在水中 | |
| C. | 从变化类型上看,物质与氧气发生的反应都是氧化反应 | |
| D. | 从应用角度看,氧气可供给呼吸 |
| A. | 碳酸氢铵$\stackrel{△}{→}$氨气+水+二氧化碳 | B. | 氧化钙+水→氢氧化钙 | ||
| C. | 铁+稀盐酸→氯化亚铁+氢气 | D. | 磷+氧气$\stackrel{点燃}{→}$五氧化二磷 |