题目内容
2.下列四个反应的生成物都是C,如果C的化学式为A2B5则该反应的化学方程式为( )| A. | 3AB2+B2=2C | B. | 2AB2+2B 2=2C | C. | 4AB 2+B 2=2C | D. | AB 2+2B 2=2C |
分析 由质量守恒定律:反应前后,原子种类、数目均不变,进行分析判断.
解答 解:A、C的化学式为A2B5,反应前A、B原子个数分别为3、8,反应后的生成物中A、B原子个数分别是4、10,A、B原子个数不相等,故选项错误.
B、C的化学式为A2B5,反应前A、B原子个数分别为2、8,反应后的生成物中A、B原子个数分别是4、10,A、B原子个数不相等,故选项错误.
C、C的化学式为A2B5,反应前A、B原子个数分别为4、10,反应后的生成物中A、B原子个数分别是4、10,A、B原子个数相等,故选项正确.
D、C的化学式为A2B5,反应前A、B原子个数分别为1、6,反应后的生成物中A、B原子个数分别是4、10,A、B原子个数不相等,故选项错误.
故选:C.
点评 本题难度不大,掌握化学反应前后原子守恒并能灵活运用是正确解答此类题的关键.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
17.实验是科学探究的重要方法.如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题.

(1)根据下表提供的实验数据,完成下表
(2)装置一和装置二中气球的位置不同,装置二(填“装置一”或“装置二”)更合理,理由是能让空气更易流通,全部通过铜粉,使氧气与铜粉充分反应.
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条)铜粉的量不足;
未待装置完全冷却至室温就读数.
(4)若实验测得的结果偏大(氧气的体积分数大于21%),可能的原因有哪些?(列举两条)反应后气球内的气体未挤出便读数;
连接注射器与玻璃管的导管容积过大.

(1)根据下表提供的实验数据,完成下表
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 25mL | 15mL | 9mL |
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条)铜粉的量不足;
未待装置完全冷却至室温就读数.
(4)若实验测得的结果偏大(氧气的体积分数大于21%),可能的原因有哪些?(列举两条)反应后气球内的气体未挤出便读数;
连接注射器与玻璃管的导管容积过大.
7.下列元素在化学反应中一定失去电子的是( )
| A. | 稀有气体元素 | B. | 活泼金属元素 | ||
| C. | 最外层只有两个电子的元素原子 | D. | 非金属元素 |
14.锌及其氧化物(ZnO,白色,难溶于水,溶于强酸)具有广泛的应用.
(一)锌的广泛应用
(1)锌被称之为“生命元素”.儿童、青少年如果缺锌严重,将会导致食欲不振和智力发育不良.经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指B.
A.单质 B.元素 C.原子 D.分子
(2)锌与铜熔合可形成“黄铜”,它属于A(选填序号).
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:
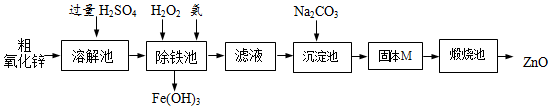
【查阅资料】一些阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的pH见表.
【问题探究】
(3)“溶解”前将粗氧化锌粉碎成细颗粒,目的是增大接触面积,加快反应速率.
(4)写出在粗ZnO样品中加硫酸发生反应的化学方程式ZnO+H2SO4═ZnSO4+H2O(选写一个).
(5)“溶解”后得到的酸性溶液中含有ZnSO4、H2SO4、FeSO4.除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为3.2~6.2.
【组成测定】固体B的组成会影响制得的ZnO的活性.为确定aZnCO3•bZn(OH)2•cH2O的组成,进行如下实验(假设每步反应、吸收均完全):
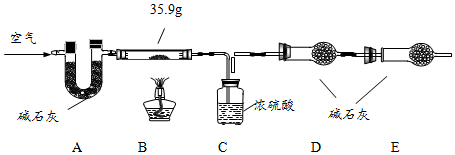
【查阅资料】aZnCO3•bZn(OH)2•cH2O受热分解生成ZnO、H2O、CO2三种产物.
(6)写出装置B中发生反应的化学方程式aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+aCO2↑+(b+c)H2O .
现称取35.9g aZnCO3•bZn(OH)2•cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2g和4.4g.
【实验分析及数据处理】
(7)装置A的作用是除去空气中二氧化碳和水.
(8)根据上述数据,则生成ZnO的质量为24.3 g;a:b:c=1:2:2.
(9)若没有E装置,则测得的a值偏大(填“偏大”、“偏小”或“不变”).
(一)锌的广泛应用
(1)锌被称之为“生命元素”.儿童、青少年如果缺锌严重,将会导致食欲不振和智力发育不良.经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指B.
A.单质 B.元素 C.原子 D.分子
(2)锌与铜熔合可形成“黄铜”,它属于A(选填序号).
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:

【查阅资料】一些阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的pH见表.
| 沉淀物 | Fe(OH)3 | Zn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 6.2 | 6.3 |
| 完全沉淀pH | 3.2 | 8.0 | 9.7 |
(3)“溶解”前将粗氧化锌粉碎成细颗粒,目的是增大接触面积,加快反应速率.
(4)写出在粗ZnO样品中加硫酸发生反应的化学方程式ZnO+H2SO4═ZnSO4+H2O(选写一个).
(5)“溶解”后得到的酸性溶液中含有ZnSO4、H2SO4、FeSO4.除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为3.2~6.2.
【组成测定】固体B的组成会影响制得的ZnO的活性.为确定aZnCO3•bZn(OH)2•cH2O的组成,进行如下实验(假设每步反应、吸收均完全):

【查阅资料】aZnCO3•bZn(OH)2•cH2O受热分解生成ZnO、H2O、CO2三种产物.
(6)写出装置B中发生反应的化学方程式aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+aCO2↑+(b+c)H2O .
现称取35.9g aZnCO3•bZn(OH)2•cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2g和4.4g.
【实验分析及数据处理】
(7)装置A的作用是除去空气中二氧化碳和水.
(8)根据上述数据,则生成ZnO的质量为24.3 g;a:b:c=1:2:2.
(9)若没有E装置,则测得的a值偏大(填“偏大”、“偏小”或“不变”).
12.下列化肥属于复合肥的是( )
| A. | NH4NO3 | B. | KCl | C. | KNO3 | D. | CO(NH2)2 |
 铁、铜、银、锌是生活中常见的金属,请根据所学知识回答下列问题.
铁、铜、银、锌是生活中常见的金属,请根据所学知识回答下列问题.