题目内容
9.小方同学将20g木炭粉和氧化铜的混合物加热至不在产生气体时,将所得气体通入100g澄清石灰水中,所得溶液质量为94.4g,则参加反应的氧化铜中的铜元素占原混合物的质量分数( )| A. | 64% | B. | 32% | C. | 80% | D. | 96% |
分析 木炭与氧化铜反应生成铜和二氧化碳,二氧化碳通入石灰水中生成碳酸钙和水,溶液质量减少,根据质量差可计算出二氧化碳的质量,进而求出参加反应的氧化铜中的铜元素的质量.
解答 解:设木炭粉和氧化铜的混合物加热生成二氧化碳的质量为x
CO2+Ca(OH)2=CaCO3↓+H2O
44 100 100-44=56
x 100g-94.4g=5.6g
$\frac{44}{56}=\frac{x}{5.6g}$
x=4.4g
设参加反应的氧化铜中的铜元素的质量为y
2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑
128 44
y 4.4g
$\frac{128}{44}=\frac{y}{4.4g}$
y=12.8g
参加反应的氧化铜中的铜元素占原混合物的质量分数:$\frac{12.8g}{20g}×100%$=64%.
故选A.
点评 运用质量差进行计算是解题的关键.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
8. 往一定量的氯化铜溶液中加入过量的锌粒,如图是反应过程中某物质的质量随加入锌粒的质量变化关系,则这种物质不可能是( )
往一定量的氯化铜溶液中加入过量的锌粒,如图是反应过程中某物质的质量随加入锌粒的质量变化关系,则这种物质不可能是( )
 往一定量的氯化铜溶液中加入过量的锌粒,如图是反应过程中某物质的质量随加入锌粒的质量变化关系,则这种物质不可能是( )
往一定量的氯化铜溶液中加入过量的锌粒,如图是反应过程中某物质的质量随加入锌粒的质量变化关系,则这种物质不可能是( )| A. | 溶液中的水 | B. | 生成的铜 | ||
| C. | 生成的氯化锌 | D. | 参加反应的氯化铜 |
17.在实验室中有一段镁条,已经部分变质为MgO,为测定其组成,取3.2g该物质,加入100g溶质质量分数为7.3%的稀盐酸中,恰好完全反应,最终得到溶液的质量为103.1g,则原混合物中镁元素的质量分数为( )
| A. | 80% | B. | 37.5% | C. | 75% | D. | 24% |
4.设计实验方案是科学探究的重要环节.以下化学实验设计中,能达到实验目的是( )
| A. | 用铜和稀硫酸反应制取硫酸铜溶液 | |
| B. | 用酚酞区分氢氧化钠溶液和碳酸钠溶液 | |
| C. | 用稀H2SO4可鉴别NaOH、K2CO3、BaCl2三种溶液 | |
| D. | 用灼烧闻气味区分羊毛绒和棉线 |
1.下列物质属于天然纤维的是( )
| A. | 涤纶 | B. | 腈纶 | C. | 羊毛 | D. | 锦纶 |
19. 元素周期表是学习化学的重要工具,如图是元素周期表中的一格,下面从该图获取的信息中,正确的是( )
元素周期表是学习化学的重要工具,如图是元素周期表中的一格,下面从该图获取的信息中,正确的是( )
 元素周期表是学习化学的重要工具,如图是元素周期表中的一格,下面从该图获取的信息中,正确的是( )
元素周期表是学习化学的重要工具,如图是元素周期表中的一格,下面从该图获取的信息中,正确的是( )| A. | 该元素的原子序数为52 | B. | 该元素属于非金属元素 | ||
| C. | 该元素在中子数为24 | D. | 该元素的原子核外有24个电子 |
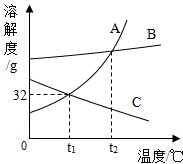 如图是A、B、C三种固体物质溶解度曲线.
如图是A、B、C三种固体物质溶解度曲线.