题目内容
19.做完“铁在氧气里燃烧”实验后,小明同学有两个疑惑不解的问题,于是他进行了以下探究活动,请你一同参与.[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1]
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸的溶液.
[实验探究]
将冷却后的黑色物质碾碎,装入试管,加入稀盐酸溶液,观察到的现象是产生气泡,说明铁燃烧时溅落下来的黑色物质中还含有铁.
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在1400℃~1538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
[拓展延伸]
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部铺一层细沙,或加入适量的水.
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色由黑色变成红棕色,就说明包装盒破损进气,这样售货员就能及时发现并处理.
分析 【实验探究】
铁和稀盐酸反应生成氯化亚铁和氢气;
【理论探讨】
根据实验现象,可以判断氧化铁分解的温度范围;
【拓展延伸】
为了防止集气瓶炸裂,必须在集气瓶底部铺一层细沙,或加入适量的水;
高温条件下,氧化铁分解生成四氧化三铁和氧气;
(3)根据颜色变化可以判断包装盒是否破损进气.
解答 解:【实验探究】
将冷却后的黑色物质碾碎,装入试管,加入稀盐酸溶液,观察到的现象是产生气泡,说明铁燃烧时溅落下来的黑色物质中还含有铁.
故填:稀盐酸;产生气泡.
【理论探讨】
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在1400℃~1538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
故填:1400℃~1538℃.
【拓展延伸】
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部铺一层细沙,或加入适量的水.
故填:在集气瓶底部铺一层细沙,或加入适量的水.
(2)Fe2O3高温时会分解成Fe3O4和氧气,此反应的化学方程式为:6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
故填:6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
(3)若粉末的颜色由黑色变成红棕色,就说明包装盒破损进气.
故填:由黑色变成红棕色.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验,观察实验现象,分析实验现象.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列基本反应类型中,一定属于氧化还原反应的是( )
| A. | 复分解反应 | B. | 置换反应 | C. | 分解反应 | D. | 化合反应 |
7.化学小组同学在课外读物中看到:“通常CO2可作灭火剂,但有些物质(如Na)着火,不能用CO2熄灭.”他们决定探究CO2与Na反应的产物.
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3.
【查阅资料】
①Na是非常活泼的金属,常温下与O2、H2O等物质反应.
②碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
③Na2O是白色固体,与H2O反应生成NaOH.
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀.
【实验过程】同学们在老师的指导下设计了如图所示装置(部分夹持仪器已略去)
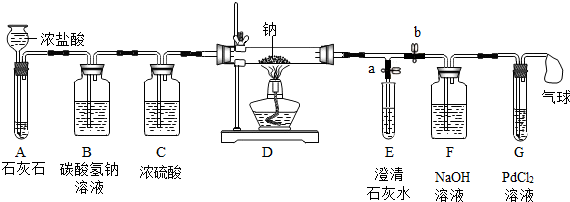
(1)实验记录
(2)实验反思
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的是排出装置中的空气,防止空气的干扰.
②装置B中发生的反应的化学方程式是NaHCO3+HCl═NaCl+H2O+CO2↑,若无装置C,对实验有影响的物质是水.
③检验第4种反应产物是否存在的实验方案:取D中白色固体于试管中,加水溶解,加水完全溶解,加入过量CaCl2溶液至不再产生沉淀,滴加酚酞试液,溶液呈红色.说明白色固体中含Na2O.
(3)数据分析:若在实验过程中至少需要8.8g二氧化碳参加反应,则最少需要含杂质20%的石灰石的质量是多少?(写出计算过程)
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3.
【查阅资料】
①Na是非常活泼的金属,常温下与O2、H2O等物质反应.
②碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
③Na2O是白色固体,与H2O反应生成NaOH.
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀.
【实验过程】同学们在老师的指导下设计了如图所示装置(部分夹持仪器已略去)

(1)实验记录
| 序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| ① | 打开a,关闭b,由长颈漏斗注入浓盐酸 | A中产生大量气泡 E中出现浑浊 | E中反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体 G中产生黑色沉淀 | 反应产物一定有C和CO |
| ③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有Na2CO3 |
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的是排出装置中的空气,防止空气的干扰.
②装置B中发生的反应的化学方程式是NaHCO3+HCl═NaCl+H2O+CO2↑,若无装置C,对实验有影响的物质是水.
③检验第4种反应产物是否存在的实验方案:取D中白色固体于试管中,加水溶解,加水完全溶解,加入过量CaCl2溶液至不再产生沉淀,滴加酚酞试液,溶液呈红色.说明白色固体中含Na2O.
(3)数据分析:若在实验过程中至少需要8.8g二氧化碳参加反应,则最少需要含杂质20%的石灰石的质量是多少?(写出计算过程)
4.葡萄糖是生命体所需能量的主要来源.
【提出问题】葡萄糖的燃烧产物是CO2和H2O,由此能否证明葡萄糖是只由碳元素和氢元素组成的有机物?
【实验设计】为了确定葡萄糖的元素组成,某小组设计了如图实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略).

(1)装置B中浓硫酸的作用是吸收从A中溢出的水蒸气.
(2)装置C处氧化铜的作用是将葡萄糖不完全燃烧产生的少量CO氧化成CO2,保证葡萄糖中的碳都转化为CO2.
【方案评价】
(1)用充有空气的储气球代替装置A,是否更有利于实验的进行?原因是否;空气中的CO2会干扰实验结果的测定.
【数据处理】下表是同学们填写的实验报告,请你帮助完成.
【讨论交流】
从定量实验的角度看,为了尽量减少误差:,该实验是否可进一步改进?请简要写出一个改进意见:
将F换成装有NaOH的干燥管,同时吸收空气中的CO2和H2O,减少实验误差.
【提出问题】葡萄糖的燃烧产物是CO2和H2O,由此能否证明葡萄糖是只由碳元素和氢元素组成的有机物?
【实验设计】为了确定葡萄糖的元素组成,某小组设计了如图实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略).

(1)装置B中浓硫酸的作用是吸收从A中溢出的水蒸气.
(2)装置C处氧化铜的作用是将葡萄糖不完全燃烧产生的少量CO氧化成CO2,保证葡萄糖中的碳都转化为CO2.
【方案评价】
(1)用充有空气的储气球代替装置A,是否更有利于实验的进行?原因是否;空气中的CO2会干扰实验结果的测定.
【数据处理】下表是同学们填写的实验报告,请你帮助完成.
| 实验事实 | 数据分析及结论 |
| 1.8g葡萄糖完全燃烧,得到2.64g CO2和1.08g H2O | 根据数据分析可得出结论: 葡萄糖中含有C、H、O元素. |
从定量实验的角度看,为了尽量减少误差:,该实验是否可进一步改进?请简要写出一个改进意见:
将F换成装有NaOH的干燥管,同时吸收空气中的CO2和H2O,减少实验误差.
11.下列除杂选用试剂正确的是( )
| A. | 用过量的O2除去CO2中的CO | B. | 用过量的HC1溶液除去Cu中CuO | ||
| C. | 用过量的NaOH除去CaCl2溶液中HCl | D. | 用过量的FeSO4,除去Zn中Fe |
9.下列与实验操作或离子检验有关的说法正确的是( )
| A. | 称量一定质量NaCl固体时,没有用烧杯,直接放在右盘的滤纸上 | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42ˉ | |
| C. | 蒸发时,待水分完全蒸干后才能停止加热 | |
| D. | 加入硝酸酸化的硝酸钡溶液既无沉淀又无气体产生,再加入硝酸银溶液,立刻产生白色沉淀,一定有Clˉ |

