题目内容
11.下列除杂选用试剂正确的是( )| A. | 用过量的O2除去CO2中的CO | B. | 用过量的HC1溶液除去Cu中CuO | ||
| C. | 用过量的NaOH除去CaCl2溶液中HCl | D. | 用过量的FeSO4,除去Zn中Fe |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、除去二氧化碳中的一氧化碳不能够通过量的氧气点燃,这是因为除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质氧气,故选项所采取的试剂错误.
B、CuO能与过量的HC1反应生成氯化铜和水,铜不与过量的HC1反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确.
C、HCl能与过量的NaOH反应生成氯化钠和水,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,故选项所采取的试剂错误.
D、Zn能与硫酸亚铁溶液反应生成硫酸锌溶液和铁,反而会把原物质除去,不符合除杂原则,故选项所采取的试剂错误.
故选:B.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
18.除去下列物质中的少量杂质(括号内为杂质)所用除去杂质的方法正确的是( )
| 选项 | 待提纯的物质 | 除去杂质的方法 |
| A | 金(铁粉) | 加入足量稀盐酸、过滤、洗涤、干燥 |
| B | 氯化钙溶液(碳酸钠) | 加入适量的稀盐酸,过滤 |
| C | H2O(有异味的物质) | 活性炭,吸附 |
| D | 氧化钙(石灰石) | 高温煅烧 |
| A. | A | B. | B | C. | C | D. | D |
2. 食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.
食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.
【提出问题】变质后,固体成分中有什么物质?颜色有什么变化?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁,氧化铁粉为红棕色.
【作出猜想】变质后的固体成分中可能含有:Fe、CaO、Fe2O3、Ca(OH)2、CaCO3.
【分析猜想】根据“双吸剂”的作用:防潮、防氧化.由此说明“双吸剂”成分中的物质可吸收水和氧气两种物质,从而可防止食品腐败.
【实验探究】三位同学的探究方案如下表.
【反思应用】
(1)综合上述探究,请分析甲、乙、丙的实验结论中,不合理的是甲、乙.
(2)采取什么实验方法可以使失效后的红棕色粉末“还原”?(用化学方程式表示)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
 食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.
食品包装中常使用一种袋装为“504双吸剂”防腐剂,标签如图所示.作用:防潮、防氧化.双吸剂变质失效后,固体中大部分是灰白色的,少许是红棕色的.甲、乙、丙三位同学对一包久置的“双吸剂”的变质情况进行探究.【提出问题】变质后,固体成分中有什么物质?颜色有什么变化?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁,氧化铁粉为红棕色.
【作出猜想】变质后的固体成分中可能含有:Fe、CaO、Fe2O3、Ca(OH)2、CaCO3.
【分析猜想】根据“双吸剂”的作用:防潮、防氧化.由此说明“双吸剂”成分中的物质可吸收水和氧气两种物质,从而可防止食品腐败.
【实验探究】三位同学的探究方案如下表.
| 实验操作 | 实验现象 | 实验结论 |
| 甲:取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时触摸试管外壁,感觉发烫,试管底部有不溶物,溶液变红色. | 甲:固体中一定含有CaO和Ca(OH)2 |
| 乙:另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 乙:固体中一定含有铁,一定不含有Fe2O3 |
| 丙:将乙产生的气体通入到澄清石灰水中 | 澄清石灰水中变浑浊 | 丙:固体中一定含有CaCO3 |
(1)综合上述探究,请分析甲、乙、丙的实验结论中,不合理的是甲、乙.
(2)采取什么实验方法可以使失效后的红棕色粉末“还原”?(用化学方程式表示)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
19.做完“铁在氧气里燃烧”实验后,小明同学有两个疑惑不解的问题,于是他进行了以下探究活动,请你一同参与.
[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1]
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸的溶液.
[实验探究]
将冷却后的黑色物质碾碎,装入试管,加入稀盐酸溶液,观察到的现象是产生气泡,说明铁燃烧时溅落下来的黑色物质中还含有铁.
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
(2)Fe2O3高温时分解成Fe3O4.
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在1400℃~1538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
[拓展延伸]
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部铺一层细沙,或加入适量的水.
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色由黑色变成红棕色,就说明包装盒破损进气,这样售货员就能及时发现并处理.
[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1]
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸的溶液.
[实验探究]
将冷却后的黑色物质碾碎,装入试管,加入稀盐酸溶液,观察到的现象是产生气泡,说明铁燃烧时溅落下来的黑色物质中还含有铁.
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在1400℃~1538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
[拓展延伸]
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部铺一层细沙,或加入适量的水.
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色由黑色变成红棕色,就说明包装盒破损进气,这样售货员就能及时发现并处理.
6.同学们运用对比的学习方法探究碱的性质.
(1)由实验一、二可知,氢氧化钠会吸收空气的H2O、CO2,因此要密封保存.
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,对比A瓶与C(选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应.
(3)同学们设计如下两种方案鉴别氢氧化钠溶液与氢氧化钙两种饱和溶液.
(4)某同学发现工业上使用的氢氧化钠固体标签如图所示,于是对其成分进行了探究:

【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】
①在化工生产中,原料往往不能完全转化为产品.
②工业上制取NaOH的反应原理是:2NaCl+2H2O$\stackrel{通电}{→}$2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体.
③碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
【提出猜想】氢氧化钠中含有的杂质为碳酸钠和氯化钠.提出上述猜想的理由是原料中的NaCl未完全反应,氢氧化钠与空气中的二氧化碳反应生成碳酸钠.
【进行实验】取固体于试管中,加水溶解并向溶液中加入过量稀盐酸
【实验结论】溶液中有明显现象,证明杂质中一定含有碳酸钠.
【反思评价】该同学想进一步证明固体中的氢氧化钠,实验方案是取少量固体于试管中加水溶解,加入过量的氯化钙溶液使沉淀完全,静置后向上层清液中滴加酚酞溶液,溶液变红,则固体中含有氢氧化钠.
(5)某碳酸钠样品中含有少量氯化钠.现称量11g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g氯化钠固体.计算:
①碳酸钠样品中碳酸钠的质量;
②反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
| 实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
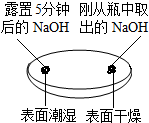 | 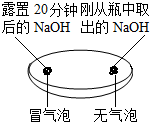 | 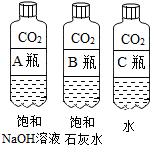 |
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,对比A瓶与C(选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应.
(3)同学们设计如下两种方案鉴别氢氧化钠溶液与氢氧化钙两种饱和溶液.
| 实验一 | 实验二 | 分析 |
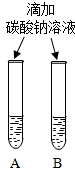 | 微热(不考虑水分蒸发)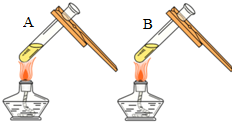 | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大. |

【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】
①在化工生产中,原料往往不能完全转化为产品.
②工业上制取NaOH的反应原理是:2NaCl+2H2O$\stackrel{通电}{→}$2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体.
③碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
【提出猜想】氢氧化钠中含有的杂质为碳酸钠和氯化钠.提出上述猜想的理由是原料中的NaCl未完全反应,氢氧化钠与空气中的二氧化碳反应生成碳酸钠.
【进行实验】取固体于试管中,加水溶解并向溶液中加入过量稀盐酸
【实验结论】溶液中有明显现象,证明杂质中一定含有碳酸钠.
【反思评价】该同学想进一步证明固体中的氢氧化钠,实验方案是取少量固体于试管中加水溶解,加入过量的氯化钙溶液使沉淀完全,静置后向上层清液中滴加酚酞溶液,溶液变红,则固体中含有氢氧化钠.
(5)某碳酸钠样品中含有少量氯化钠.现称量11g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g氯化钠固体.计算:
①碳酸钠样品中碳酸钠的质量;
②反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
16.某化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
[提出问题]该氢氧化钠溶液是否变质了呢?
【知识回顾】氢氧化钠溶液变质的原囚,写出相应的化学方程式2NaOH+CO2═Na2CO3+H2O;
【实验设计】针对氢氧化钠溶液可能全部变质这个猜想,某同学提出一个实验设计方案:
向取样后的待测溶液中加入酚酞试液,如果不变色,说明全部变质,你认为该方案不可行(填“可行”或“不可行”理由是碳酸钠溶液呈碱性,能使酚酞变红.
[实验探究]
【实验拓展】(注意:若答对本小题奖励4分,化学试卷总分不超过60分.)
根据你所学习到的有关酸碱盐的知识,用类别不同于[实验探究]环节中所用试剂来鉴定该氢氧化钠溶液是否变质:
[提出问题]该氢氧化钠溶液是否变质了呢?
【知识回顾】氢氧化钠溶液变质的原囚,写出相应的化学方程式2NaOH+CO2═Na2CO3+H2O;
【实验设计】针对氢氧化钠溶液可能全部变质这个猜想,某同学提出一个实验设计方案:
向取样后的待测溶液中加入酚酞试液,如果不变色,说明全部变质,你认为该方案不可行(填“可行”或“不可行”理由是碳酸钠溶液呈碱性,能使酚酞变红.
[实验探究]
| 实验操作 | 实验现象 | 实验结论 |
| 取少量该溶液于试管中,向溶液中滴加足量的盐酸,振荡. | 有气泡产生. | 氢氧化钠溶液一定变质了. |
根据你所学习到的有关酸碱盐的知识,用类别不同于[实验探究]环节中所用试剂来鉴定该氢氧化钠溶液是否变质:
| 实验操作 | 实验现象 | 实验结论 |
| 氢氧化钠溶液一定变质了. | ||
| 氢氧化钠溶液一定变质了. |
20.取4份等质量的KClO3,向其中3份中分别加入少量等质量的KMnO4、MnO2和Mn,分别在某温度下加热至质量不再改变,测定产生氧气的质量.然后将剩余固体溶于足量水中,添加过少量物质的组别中均有相同组成的不溶物.测定结果如表:
已知ml>m2>m3,下列关于此实验的说法一定正确的是( )
| 组别 | ① | ② | ③ | ④ |
| 加入物质 | 无 | KMnO4 | MnO2 | Mn |
| 产生氧气的质量/g | 0 | ml | m2 | m3 |
| 不溶物的质量/g | 0 | wl | w2 | w3 |
| A. | 残留不溶性物质的质量关系为w1>w2>w3 | |
| B. | 不加入其他物质时,KClO3未发生分解反应 | |
| C. | KMnO4是KClO3分解制氧气效果最好的催化剂 | |
| D. | 3种物质的加入都有利于KClO3分解制氧气 |
1.学校食堂提供了下列5种食物:①青菜②苹果③米饭④猪肉⑤鱼.较合理的组合是( )
| A. | ①②③ | B. | ①③⑤ | C. | ①④⑤ | D. | ③④⑤ |