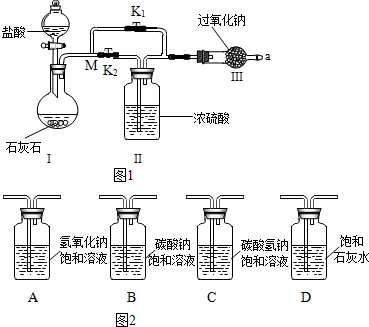
题目内容
13. 已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化为Fe(OH)3红褐色沉淀.图为Fe(OH)2制备实验的改进装置,原理是首先利用A试管产生的氢气排出B装置中的空气,再利用A中产生的FeSO4和NaOH反应,使用该装置能在较长的时间内观察到生成的Fe(OH)2白色絮状沉淀.
已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化为Fe(OH)3红褐色沉淀.图为Fe(OH)2制备实验的改进装置,原理是首先利用A试管产生的氢气排出B装置中的空气,再利用A中产生的FeSO4和NaOH反应,使用该装置能在较长的时间内观察到生成的Fe(OH)2白色絮状沉淀.(1)Fe(OH)2在物质分类中属于碱.(填“酸”、“碱”、“盐”、“氧化物”)
(2)写出A试管中发生反应的化学方程式Fe+H2SO4=FeSO4+H2↑;
(3)A试管中的反应开始时,打开止水夹,B试管中看到的现象是冒气泡;
(4)若要在该装置中得到Fe(OH)2白色絮状沉淀,并在一段时间内防止被氧化为Fe(OH)3红褐色沉淀,下一步的实验操作是关闭止水夹;
(5)写出B装置中生成Fe(OH)2的化学方程式FeSO4+2NaOH=Fe(OH)2↓+Na2SO4.
分析 根据题干提供的信息结合物质的类别以及化学方程式的书写和反应的实验现象进行分析解答即可.
解答 解:(1)Fe(OH)2在电离时产生的阴离子全部是氢氧根离子,物质分类中属于碱类物质,故填:碱;
(2)铁与硫酸反应生成硫酸亚铁和氢气,故填:Fe+H2SO4=FeSO4+H2↑;
(3)A中产生的气体进入B中,会出现气泡,故填:冒气泡;
(4)要得到氢氧化亚铁的沉淀,需要防止氧气进入装置内,因此需要关闭止水夹,故填:关闭止水夹;
(5)硫酸亚铁和氢氧化钠反应生成氢氧化亚铁和硫酸钠,故填:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4.
点评 本题考查的是常见的碱的性质以及氢氧化亚铁的制备,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
3. 如图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使反应顺利进行,则可以从长颈漏斗中添加的试剂是( )
如图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使反应顺利进行,则可以从长颈漏斗中添加的试剂是( )
①食盐水;②NaOH溶液;③稀盐酸;④Na2CO3溶液;⑤ZnSO4溶液.
 如图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使反应顺利进行,则可以从长颈漏斗中添加的试剂是( )
如图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使反应顺利进行,则可以从长颈漏斗中添加的试剂是( )①食盐水;②NaOH溶液;③稀盐酸;④Na2CO3溶液;⑤ZnSO4溶液.
| A. | ①②④ | B. | ①③④ | C. | ②③⑤ | D. | ①③⑤ |
1.利用化学知识,可以趋利避害.下列说法中错误的是( )
| A. | 合理使用化肥和农药有利于保护水资源 | |
| B. | 煤气泄露要禁止明火 | |
| C. | 食品袋内充入氮气能延缓食品变质 | |
| D. | 用硫熏蒸使生姜色泽鲜亮 |
18.推理是一种重要的学习方法.下列推理中正确的是( )
| A. | 有机物中都含有碳元素,含碳元素的化合物都是有机物 | |
| B. | 单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质 | |
| C. | 酸性溶液的pH小于7,所以酸溶液的pH也一定小于7 | |
| D. | 在同一化合物中,金属元素显正价,所以非金属元素一定显负价 |
3.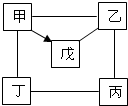 如图中“-”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以转化.下面四组选项中,符合如图要求的是( )
如图中“-”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以转化.下面四组选项中,符合如图要求的是( )
 如图中“-”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以转化.下面四组选项中,符合如图要求的是( )
如图中“-”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以转化.下面四组选项中,符合如图要求的是( )| 甲 | 乙 | 丙 | 丁 | 戊 | |
| A | Na2CO3 | Ca(OH)2 | NaOH | HCl | CO2 |
| B | HCl | Fe2O3 | H2SO4 | Zn | CuCl2 |
| C | C | CuO | HCl | O2 | CO |
| D | Al | H2SO4 | NaOH | CuCl2 | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |


 小明测定一瓶稀盐酸的溶质质量分数,具体步骤如下:
小明测定一瓶稀盐酸的溶质质量分数,具体步骤如下: