题目内容
2.课外小组同学用实验证明“二氧化碳与水接触时才能和过氧化钠反应”.(1)实验准备
【查阅资料】
①过氧化钠能与水、二氧化碳,盐酸反应,反应过程中均有氧气放出.
过氧化钠与二氧化碳反应时,除生成氧气外,还生成一种工业上制玻璃的原料.
②CO2能与碳酸钠水溶液反应生成碳酸氢钠,CO2在饱和的碳酸氢钠溶液中几乎不溶解.
【设计方案】
①小组同学设计了如图1所示的实验装置.
②老师指出,应在M点前增加下列 (图2)C装置,才能得到更准确的实验结论.
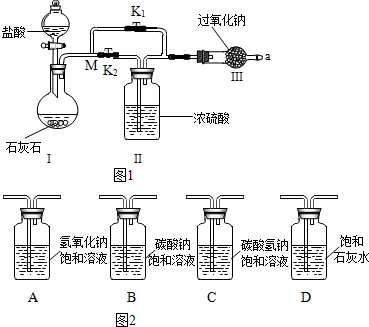
(2)实验过程:
①连接仪器,检查装置的气密性,将K1、K2关闭;
②向装置中分别加入所需药品.
③实验时,先打开K2(填K1或K2 ),将带火星的木条置于a口处,一段时间后,关闭它,再打开另一个弹簧夹,再将带火星的木条置于a口处.
④实验过程中观察到带火星的木条始终不复燃.
(3)实验分析:
①为观察到最终木条复燃,为除去未充分反应的CO2和水蒸气的干扰,你认为该如何改进Ⅲ后安装一个盛有碱石灰的干燥管;②乙认为即使先打开一个弹簧夹,再打开另一个弹簧夹后,最终观察到木条复燃,也不能证明CO2与Na2O2发生反应,原因是水也与Na2O2反应生成氧气.
(4)实验反思:
丙同学认为:应进一步证明CO2与Na2O2反应生成新物质.他补充的实验是:取Ⅲ中反应后所得固体滴加稀盐酸,产生大量气泡,将产生气体通入澄清石灰水,则证明有新物质生成.
分析 (1)②盐酸和碳酸钙反应时可能会带出一部分氯化氢,为了使实验更准确应该在M点前加上一个除去氯化氢的装置,根据题给的信息可以知道,碳酸氢钠不能和二氧化碳反应,所以可以在M点前添加C装置,可以据此解答该题;
(2)③根据实验目的可以知道,先通入干燥的二氧化碳,来判断干燥的二氧化碳是否能够和过氧化钠反应,所以打开的止水夹为K2,可以据此解答;
(3)①二氧化碳不支持燃烧,也不能燃烧,当二氧化碳通过过氧化钠时,不可能全部反应,所以应该除去二氧化碳,再进行检验,可以据此解答该题;
②根据查阅资料部分可以知道,水也能够和过氧化钠反应生成氧气,可以据此解答该题.
解答 解:(1)②盐酸和碳酸钙反应时可能会带出一部分氯化氢,为了使实验更准确应该在M点前加上一个除去氯化氢的装置,根据题给的信息可以知道,碳酸氢钠不能和二氧化碳反应,所以可以在M点前添加C装置;
(2)③根据实验目的可以知道,先通入干燥的二氧化碳,来判断干燥的二氧化碳是否能够和过氧化钠反应,所以打开的止水夹为K2;
(3)①二氧化碳不支持燃烧,也不能燃烧,当二氧化碳通过过氧化钠时,不可能全部反应,所以应该除去二氧化碳,再用带火星的木条来检验是否产生了氧气;
②根据查阅资料部分可以知道,而水也能够和过氧化钠反应生成氧气,所以不能判断是二氧化碳和水接触后再和过氧化钠发生了反应.
故答案为:(1)②C;
(2)③K2;
(3)①Ⅲ后安装一个盛有碱石灰的干燥管(吸收CO2和水的装置即可);
②水也与Na2O2反应生成氧气;
点评 本考点的命题方向主要是通过设置实验探究题,让学生进行实验设计,或者探究分析,归纳总结出物质变化的条件和影响物质变化的因素,思考解答这类题目时,可以利用控制变量法,通过设计对照实验.

练习册系列答案
相关题目
12.日常生活中发生的下列变化都属于化学变化的一组是( )
| A. | 食盐溶解,米饭变馊 | B. | 酒精挥发,木材燃烧 | ||
| C. | 蜡烛熔化,钢铁生锈 | D. | 火药爆炸,牛奶变酸 |
10.小柯同学在学习了酶的知识后了解到了酶的催化作用要受到温度、酸碱度(pH)的影响.联系到前面学习的知识,小柯同学又提出了自己的一个猜想:酶的催化作用可能会受到重金属离子的影响.结合猜想小柯进行了如下探究:
【查阅资料】重金属指密度大于5克/厘米3的金属(一般指密度大于4.5克/厘米3的金属).
【设计实验】取试管4支,编号,按下表分别加入试剂,摇匀,迅速置于37℃的水浴中,10分钟后取出,冷却后分别加入碘液3滴,观察其颜色变化.
根据小柯同学的探究过程回答下列问题:
【实验结果】(1)若酶遇到重金属离子会失去活性.则第四组实验加入碘液3滴后的现象是变蓝色.
【交流和评价】(2)在看了小柯的设计及实验后,同桌的小温认为凭上述实验还不足以证明小柯的猜想.小温提出应该将实验中的CuSO4溶液更换成CuCl2溶液才更有说服力.小温的理由是排除硫酸根离子对实验的干扰或前面加氯化钠已经说明氯离子对实验无影响.
【拓展和应用】(3)若有人误食被电镀厂废水[含铬(Cr)、镍(Ni)、镉(Cd)]污染的食物而急性中毒,为解毒,下列四种供选物质中你不应该选择的是D.
A.鸡蛋清 B.鲜豆浆 C.鲜牛奶 D.糖水.
【查阅资料】重金属指密度大于5克/厘米3的金属(一般指密度大于4.5克/厘米3的金属).
【设计实验】取试管4支,编号,按下表分别加入试剂,摇匀,迅速置于37℃的水浴中,10分钟后取出,冷却后分别加入碘液3滴,观察其颜色变化.
| 编号 | 0.25%淀粉溶液(ml) | 蒸馏水(ml) | 1%NaCl 溶液(ml) | 1%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液3滴后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝色 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝色 |
【实验结果】(1)若酶遇到重金属离子会失去活性.则第四组实验加入碘液3滴后的现象是变蓝色.
【交流和评价】(2)在看了小柯的设计及实验后,同桌的小温认为凭上述实验还不足以证明小柯的猜想.小温提出应该将实验中的CuSO4溶液更换成CuCl2溶液才更有说服力.小温的理由是排除硫酸根离子对实验的干扰或前面加氯化钠已经说明氯离子对实验无影响.
【拓展和应用】(3)若有人误食被电镀厂废水[含铬(Cr)、镍(Ni)、镉(Cd)]污染的食物而急性中毒,为解毒,下列四种供选物质中你不应该选择的是D.
A.鸡蛋清 B.鲜豆浆 C.鲜牛奶 D.糖水.
17. 小明买了一种“汽泡爽”的冲调饮料.
小明买了一种“汽泡爽”的冲调饮料.
小明阅读资料发现:“汽泡爽”原料中的柠檬酸和小苏打(NaHCO3)粉末混合后加水,可以发生以下反应,3NaHCO3+C6H8O7=C6H5O7Na3+3H2O+3CO2↑
(1)小明想探究加水温度对产生气体量的影响,小明设计了如下实验方案.
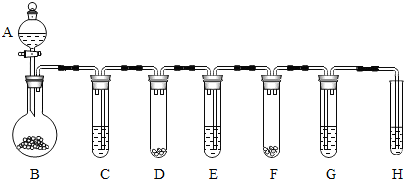
在老师的帮助下,小明采用相同的两套实验装置(如图)分别完成上述实验,在A中加入水,再加入一袋“汽泡爽”,迅速塞紧胶塞.量筒C用于收集A中产生的气体所排出的液体,冷却至室温后读取数据.B中油层的作用是防止二氧化碳气体溶解在水中
(2)通过实验,小明测得:a=64mL,b=82mL,由此获得结论:
“汽泡爽”产生气体的量与加水温度有关系.但是老师看到小
明的实验报告后却指出:两套装置中,“汽泡爽”产生气体的 A B C
总量应该近似相等,与温度关系不大,其本质原因是反应物质量没变.
(3)通过反思,为了证明老师的观点,小明继续利用(3)中已反应完的两套装置,又做了一步实验,发现两套装置最终收集到的气体的总量确实相近,他的实验操作是不断摇动锥形瓶A,继续收集气体并测量体积.
 小明买了一种“汽泡爽”的冲调饮料.
小明买了一种“汽泡爽”的冲调饮料.小明阅读资料发现:“汽泡爽”原料中的柠檬酸和小苏打(NaHCO3)粉末混合后加水,可以发生以下反应,3NaHCO3+C6H8O7=C6H5O7Na3+3H2O+3CO2↑
(1)小明想探究加水温度对产生气体量的影响,小明设计了如下实验方案.
| 实验序号 | 加入水的体积 | 加入水的温度 | 收集到的气体的体积 |
| 1 | 200mL | 15℃ | a(待记录) |
| 2 | 200mL | 50℃ | b(待记录) |
(2)通过实验,小明测得:a=64mL,b=82mL,由此获得结论:
“汽泡爽”产生气体的量与加水温度有关系.但是老师看到小
明的实验报告后却指出:两套装置中,“汽泡爽”产生气体的 A B C
总量应该近似相等,与温度关系不大,其本质原因是反应物质量没变.
(3)通过反思,为了证明老师的观点,小明继续利用(3)中已反应完的两套装置,又做了一步实验,发现两套装置最终收集到的气体的总量确实相近,他的实验操作是不断摇动锥形瓶A,继续收集气体并测量体积.
14.据英国《自然》杂志网站2月5日报道,美国科学家使用特殊的催化剂,在阳光下将水变成了可燃的甲烷,这让饱受能源枯竭威胁的人类看到了希望.帮助他们完成这一转化的是一个小小的二氧化钛(TiO2)纳米管.科学家们用这种纳米管催化水蒸气和二氧化碳,结果得到了甲烷(一种碳氢化合物,是天然气、沼气、煤气等的主要成分).则下列说法中错误的是( )
| A. | 从化学原理上讲,这一反应没有违背质量守恒定律 | |
| B. | 甲烷是一种有机物,它能在空气中燃烧 | |
| C. | 二氧化钛是一种金属氧化物,反应前后它的质量不变 | |
| D. | 这一反应是一个化合反应 |
12.若将点燃的镁带插入盛满CO2的集气瓶中,镁带将继续燃烧,该反应的文字式可表示为“镁+二氧化碳$\stackrel{点燃}{→}$氧化镁+碳”.下列关于该反应的说法正确的是( )
| A. | CO2不能燃烧,也不能支持燃烧 | |
| B. | CO2不能支持燃烧 | |
| C. | 反应生成的固体属于混合物 | |
| D. | 该反应属于化合反应,不属于分解反应 |
 已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化为Fe(OH)3红褐色沉淀.图为Fe(OH)2制备实验的改进装置,原理是首先利用A试管产生的氢气排出B装置中的空气,再利用A中产生的FeSO4和NaOH反应,使用该装置能在较长的时间内观察到生成的Fe(OH)2白色絮状沉淀.
已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化为Fe(OH)3红褐色沉淀.图为Fe(OH)2制备实验的改进装置,原理是首先利用A试管产生的氢气排出B装置中的空气,再利用A中产生的FeSO4和NaOH反应,使用该装置能在较长的时间内观察到生成的Fe(OH)2白色絮状沉淀.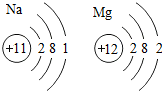 )推知,金属Na、Mg性质不同的原因是最外层电子数不同(合理即可);一氧化碳和二氧化碳性质不同的原因是分子构成不同(合理即可).由此可见,物质的结构决定物质的性质.
)推知,金属Na、Mg性质不同的原因是最外层电子数不同(合理即可);一氧化碳和二氧化碳性质不同的原因是分子构成不同(合理即可).由此可见,物质的结构决定物质的性质.