题目内容
6.某工厂用CaSO4悬浊液、NH3和CO2制备(NH4)2SO4,其工艺流程如图: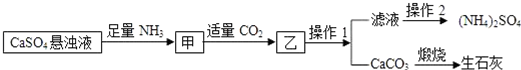
(1)先通氨气再通二氧化碳的原因促进二氧化碳的吸收.
(2)硫酸铵在农业生产中的用途是氮肥,写出利用该流程制备(NH4)2SO4的化学方程式:CaSO4+2NH3+H2O+CO2=CaCO3↓+(NH4)2SO4.
(3)通过查阅溶解度曲线知(NH4)2SO4的溶解度随温度变化较大,那么提纯滤液以获得(NH4)2SO4晶体,必要的操作2中包含步骤有BCD.
A.蒸干 B.蒸发 C.冷却结晶 D.过滤
(4)上述生成流程中,有关NH3的作用及说明正确的是ABD.
A.提供制备所需的氮元素 B.增大CO32-的浓度促进反应发生
C.作反应的催化剂 D.生产132g(NH4)2SO4,至少消耗34g NH3.
分析 根据物质制备的过程、物质的性质、化学方程式的书写方法以及根据化学方程式的计算分析解答即可.
解答 解:(1)氨气的水溶液呈碱性,先通氨气再通二氧化碳能促进二氧化碳的吸收,故填:促进二氧化碳的吸收;
(2)硫酸铵属于氮肥,可以用作氮肥使用,该流程中硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀,故填:氮肥;CaSO4+2NH3+H2O+CO2=CaCO3↓+(NH4)2SO4;
(3)(NH4)2SO4的溶解度随温度变化较大,要提纯滤液以获得(NH4)2SO4晶体,需要进行蒸发浓缩、冷却结晶过滤的操作,故填:BCD;
(4)A.氨气能提供制备所需的氮元素,正确;
B.氨气溶于水形成的溶液呈碱性,增大CO32-的浓度促进反应发生,正确;
C.氨气不是作反应的催化剂,错误;
D.设生产132g(NH4)2SO4,至少消耗NH3的质量为x
CaSO4+2NH3+H2O+CO2=CaCO3↓+(NH4)2SO4
34 132
x 132g
$\frac{34}{132}=\frac{x}{132g}$x=34g
故生产132g(NH4)2SO4,至少消耗34g NH3.
故填:ABD.
点评 本题考查的是常见的物质的制取的知识,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
相关题目
12.某金属工艺品,同学们认为它可能和铁一样,有磁性,在讨论时有同学提出“我们可以拿磁铁来吸一下”,就“拿磁铁来吸一下”这一过程而言,属于科学探究中的( )
| A. | 猜想与假设 | B. | 收集证据(实验) | C. | 获得结论 | D. | 反思与评价 |
18.高纯氧化钙是用于电子工业重要的无机化工原料.用硝酸钙溶液制备高纯氧化钙的工艺流程如下:

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 反应池中的化学方程式为:CO2+2NH3•H2O+Ca(NO3)2═2NH4NO3+CaCO3↓ | |
| B. | 操作A为蒸发结晶 | |
| C. | 该工艺流程中可以循环使用的物质是CO2 | |
| D. | 冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有杂质Ca(OH)2 |